数据 / 观察资讯
市场监管总局食品审评中心发布保健食品相关告示文件
2021-10-12 10:06 来源:新营养
 国家市场监督管理总局食品审评中心发布保健食品相关告示文件,以下内容为技术审评要求及共性问题解答及其他专栏内容:
国家市场监督管理总局食品审评中心发布保健食品相关告示文件,以下内容为技术审评要求及共性问题解答及其他专栏内容:
技术审评要求
- 原料使用及配伍
1.原料为提取物的保健食品应符合的要求
2.保健食品申报审批时文献资料要求
文献依据:包括在国内核心专业期刊或国际专业期刊正式发表的科研论文;我国传统本草典籍的有关记述;文献分析和评价报告;国际公认的食品卫生权威机构或组织,或者我国权威机构或有关部门,正式发布的国际标准、国家标准、风险评估、统计信息等。
3.保健食品原料及相关技术要求
4.申报以核酸为原料的保健食品的要求
核酸类保健食品是指以核酸为原料,辅以相应的协调物质生产的保健食品。“协调物质”是指与增强免疫力功能相关,并能与核酸协调配伍使产品具有增强免疫力功能的物质。在申报这类保健食品时首先应注意申报材料的特殊性:配方及配方依据应提供所用核酸的具体成分名称、来源、含量;提供有资质的检验机构出具的核酸原料纯度的检测报告。同时,在准备申报材料时,还应注意以下几点:
1)核酸类保健食品的功能申报范围暂限定为增强免疫力功能。
2)不得以单一的DNA或RNA作为原料申报保健食品,产品配方必须辅以相应的协调物质。目前,协调物质暂限定为普通食品、营养素以及药食同源的物品,同时应提供核酸与上述物品配伍的科学文献依据。
3)核酸的每日推荐食用量为0.6-1.2g。
4)在进行保健功能学评价试验时,除设立高、中、低三个剂量组外,还需增设中剂量配料对照组,当样品组与空白对照组、配料组比较均有统计学差异时,方可以核酸作为功效成分标示;但所有产品均不得以“核酸”命名。
5)标签、说明书中“不适宜人群”增加“痛风患者”。
- 毒理学评价
1.应进行毒力试验的原料要求
以可食大型真菌子实体为原料生产的保健食品仅需提供品种鉴定报告。以大型真菌菌丝体、小型丝状真菌子实体或菌丝体以及益生菌为原料申请注册的保健食品须严格按照《真菌类保健食品申报与审评规定(试行)》和《益生菌类保健食品申报与审评规定(试行)》的有关要求,逐项提供相关资料及试验报告。
- 功能学评价
1.功能评价试验与兴奋剂检测的样品批号要求
所有试验所用样品,在开展功能评价试验与兴奋剂检测时,批号必须一致。
2.对于功能学评价试验先后顺序的要求
人体功能学试验项目顺序问题其实是一个伦理学问题,其核心是保证受试对象的食用安全,不能在人体试食试验时对受试对象产生任何急性、亚急性及慢性危害。人体试食试验必须在卫生学试验、动物毒理学安全性试验及兴奋剂检测(仅限缓解体力疲劳、促进生长发育、减肥功能)完成之后,确定试食产品是安全的并符合有关卫生标准要求的情况下再进行,原则上还应在动物功能学评价试验证明其有效的前提下进行。人体试食试验报告中应注明试验开始日期和报告日期。
3.保健食品注册检验机构要求
请进入特殊食品验证评价技术机构备案信息系统查询。(https://tsspjg.gsxt.gov.cn/)
4.保健食品人体试食试验功能学评价申报资料的规定
为规范和完善功能学评价申报资料,规定如下:
一、保健食品产品注册申报资料中应当增加伦理委员会出具的允许开展该人体试食试验证明文件的复印件。复印件须加盖检验机构印鉴,附于人体试食试验报告后。
二、 2009年 6月 20日前已受理的产品,涉及人体试食试验的,申请人应当向国家食品药品监督管理局保健食品审评中心补交上述证明文件的复印件;自 2009年 6月 20日起受理的保健食品,申报资料中应当包含该证明文件。
5.进行功能学评价试验时对受试物的要求
1)受试物必须是在产品保质期内。
2)受试物应为符合既定配方和生产工艺的规格化产品,其组成成分、比例及纯度应与实际产品相同,如需特殊处理的受试物(如浓缩、去除辅料等),试验报告中应说明处理方法及理由,处理工艺应与样品生产工艺一致。
3)与毒理学、卫生学、稳定性试验、兴奋剂检测所用受试物同一批号,若保质期内无法完成全部试验项目的样品(如:酸奶等),允许使用不同批号的样品,但应说明理由。
4)含乙醇的受试物,如乙醇含量超过15%,应将乙醇含量降至15%,调整受试物乙醇含量应使用原产品的酒基。
6.进行动物功能学评价试验时对实验动物的要求
应根据各项实验的具体要求合理选择实验动物,最常用的实验动物为大鼠和小鼠,根据《实验动物管理条例》的有关规定,保健食品评价实验必须选择清洁级以上大鼠和小鼠。
7.检验单位在启动人体试食试验时的要求
如果人体试食试验与其它项目的试验未在同一检验机构进行,委托单位必须向负责人体试食试验的机构提供同批次受试样品的卫生学及功效成份检测结果、毒理学安全性评价试验结果、动物功能学试验结果以及兴奋剂检测结果(兴奋剂检测仅限缓解体力疲劳、促进生长发育、减肥功能),人体试食试验进行前必须得到本单位伦理学审查委员会的批准。
8.含糖及乙醇的“缓解体力疲劳”功能产品应设置对照组的要求
糖及乙醇均有一定的缓解体力疲劳作用,以其为载体和功效成分组成的受试样品,当载体本身可能具有相同功能时,应将该载体作为对照。按此规定,含糖的保健食品,糖量超过30%,或每日绝对摄入量超过30g应设糖对照组;含乙醇的保健食品,应设乙醇对照组(当乙醇含量超过15%时,应用原产品的酒基,将乙醇浓度调至15%)。
9.一个产品能申报健功能的个数要求
《保健食品注册与备案管理办法(2020年修订版)》对一个产品可申报几个保健功能未作规定,申请人可以根据产品配方及依据,自行确定申报保健功能的名称和功能数量。申请人确定的保健功能的名称和功能数量必须有充分的科学依据,并经动物功能试验和/或人体试食试验证明。一个产品申报两个或两个以上功能时,要说明功能之间的关联性,并有科学依据,要注意产品适宜人群和不适宜人群的一致,不能互相矛盾。一般来说,一个产品的功能越多,其产品的适宜人群越少。因此,申报保健食品时,申报的保健功能不是越多越好。
增加保健功能的保健食品,必须已取得保健食品批准证书,并在批件有效期内。增加的功能必须是在国家食品药品监督管理局公布的保健功能范围内(目前公布的保健功能为27项),不得申请增加不在公布范围内的保健功能,但对增加保健功能的数量没有限制。申请人增加保健功能时,应进行增加保健功能的动物功能试验和/或人体试食试验,并说明增加功能与原功能之间的关系,并具有充分的科学依据。增加保健功能时,要对产品的适宜人群和不适宜人群进行重新审定,一般情况下,随着功能数量的增加,其产品的适宜人群相应减少,不适宜人群增加,申请人应予注意。
10.新修订公布的抗氧化等9个保健功能评价方法的实施要求
国家食品药品监督管理局组织修订了抗氧化等9个功能的评价方法,已经保健食品安全专家委员会审议通过,已予印发。自2012年5月1日起,对受理的申报注册保健食品的相关产品检验申请,保健食品注册检验机构应当按照新发布的9个功能评价方法开展产品功能评价试验等各项工作。
11.申报仅针对少年儿童、孕妇乳母等特殊人群的特定保健功能食品时,对动物功能和毒理
针对少年儿童、孕妇乳母等特殊人群的特定保健功能食品,其食用安全性和保健功能必须具有充足的科学理论、文献和试验依据作为支持。注册检验应当符合现行的有关规定,并充分考虑试验项目,试食人群、剂量设计的特殊性、科学性和合理性。涉及人体试食试验的,开展试验前应当完成必要的安全性毒理学试验、卫生学试验,并出具书面证明和取得试验机构伦理委员会的伦理审查批件。安全性毒理学试验、卫生学试验不合格的样品不得进行功能学人体试食试验。
12.在喂养试验中,饲料的蛋白含量的调整要求
当饲料中掺入不含营养素的受试物或掺入糖类或乳粉类等热量、蛋白质或其它营养素(如宏量营养素和微量营养素)含量高于普通饲料的受试物且掺入量比较大(>5%)时,各剂量组饲料与对照组饲料在热量、营养素方面应调整一致,且各种营养素的含量应符合实验动物饲料的有关要求(参照GB 14924.3-2010实验动物 配合饲料营养成分)。
- 产品生产工艺
1.保健食品灭菌工艺条件的选择和验证要求
为进一步明确保健食品灭菌工艺条件的研发和审评要求,我中心组织专题研讨会,对审评相关问题进行了研究,现将有关情况发布如下,供保健食品注册申请时参考。
一、保健食品常用灭菌方法及关键工艺参数
保健食品加工过程常用的灭菌方法包括湿热灭菌法(含流通蒸汽灭菌、热压灭菌)、辐照灭菌法、微波灭菌法、过滤除菌法、瞬间高温灭菌法等。
湿热灭菌法为热力灭菌中最有效,应用最广泛的灭菌方法,固体制剂、口服液以及遇高温和潮湿不发生变化或破坏的原料或成品,均可采用本法灭菌,关键工艺参数为温度、时间。
瞬间高温灭菌法是为有效地保留待灭菌液体物料的功效成分,将液体在封闭的系统经高温、短时处理后迅速冷却至室温的一种方法,主要用于饮料的灭菌,关键工艺参数为温度、时间。本法需综合考虑产品pH值、初始染菌情况、生产环境与保质期需求,并应与无菌灌装工艺配合使用。其中超高温瞬时灭菌法通常采用130~150℃,3~5s。
微波灭菌法是以热效应和非热效应共同作用,使物品内外均匀迅速升温实现灭菌,目前主要用于粉末状或细小颗粒状原料及成品的灭菌,关键工艺参数为微波频率、时间。
过滤除菌法利用细菌不能通过致密具孔滤材的原理以除去液体中微生物的方法,常用于含热不稳定成分的液体除菌,关键工艺参数为滤材孔径(一般≤0.22µm)。
辐照灭菌法最常用的为60Co-γ射线辐照灭菌,主要适用于辐照灭菌条件下不易发生质量变化的固体原料及终产品,关键工艺参数为辐照源、辐照剂量。
注:
1)气体灭菌法:臭氧具有强氧化性且不具穿透力无法保证产品质量稳定,环氧乙烷、甲醛毒副作用明显,均不属于 GB2760《食品安全国家标准 食品添加剂使用标准》规定的加工助剂,不得用于保健食品原料及成品灭菌。
2)紫外杀菌可用于表面消毒,一般不用于终产品或原料灭菌。
二、保健食品灭菌工艺条件研究要求
保健食品灭菌方法及工艺参数的确定应以不引起原料或成品质量发生实质性改变为前提,同时综合考虑被灭菌物料的成分(如:防腐剂、氨基酸蛋白质类成分含量等)、理化特征(如:性状、pH值、渗透压等)与初始染菌情况,以及灭菌方法的有效性、灭菌后物料的稳定性、终产品包装等因素,严格把控产品在选定灭菌条件下的质量安全风险。对于灭菌工艺研究资料,根据产品灭菌方法与参数的依据不同,要求不同。
(一)对于采用国家相关标准及《中国药典》收载的食品或口服制剂灭菌条件进行灭菌的,暂不要求提供灭菌条件确立的研究资料,但应考察灭菌前后样品中功效成分 /标志性成分含量、感官及微生物数量(菌落总数、大肠菌群)等变化情况,并说明该灭菌条件适用性。
(二)对于采用国家相关标准及《中国药典》收载的食品或口服制剂灭菌方法,但灭菌工艺参数为自行选定的,应提供该灭菌方法及工艺参数的来源以及选择和确定的合理性依据,以及以下研究资料。
1)不同灭菌工艺参数对功效/标志性成分含量影响的对比研究
采用产品技术要求中规定的检测方法,对不同工艺参数处理后的功效成分 /标志性成分含量变化,进行对比研究。
2)不同灭菌工艺参数处理后微生物状况变化对比研究
参考《中国药典》,根据不同的灭菌方法使用不同的生物指示剂(一般为细菌的孢子)和菌落总数、大肠菌群、金黄色葡萄球菌、沙门氏菌指标,考察不同灭菌参数处理后样品中微生物状况。
3)不同灭菌工艺参数对产品感官指标影响的对比研究
采用产品技术要求中规定的检测方法,对不同工艺参数处理后的产品感官指标变化,进行对比研究。
三、关于保健食品采用辐照灭菌的要求
保健食品及原料采用辐照灭菌应充分说明其必要性和合理性。为在达到灭菌效果的前提下,把对产品质量安全影响风险降到最低,建议尽可能采用低剂量辐照灭菌,且应开展辐照前后的对比研究,充分说明辐照灭菌前后保健食品所含成分种类或含量的变化情况及其灭菌效果,证明所采用灭菌工艺参数的合理性。有研究表明辐照过程可能会影响产品质量安全,或有规定不得使用辐照灭菌的物料,不得采用辐照灭菌。
2.保健食品稳定性试验指导原则
保健食品注册检验机构应按照国家相关规定和标准等要求,根据样品具体情况,合理地进行稳定性试验设计和研究。
一、基本原则
(一)保健食品稳定性试验是指保健食品通过一定程序和方法的试验,考察样品的感官、化学、物理及生物学的变化情况。
(二)通过稳定性试验,考察样品在不同环境条件下(如温度、相对湿度等)的感官、化学、物理及生物学随时间增加其变化程度和规律,从而判断样品包装、贮存条件和保质期内的稳定性。
(三)根据样品特性不同,稳定性试验可采取短期试验、长期试验或加速试验。
1.短期试验:该类样品保质期一般在6个月以内(含6个月),在常温或说明书规定的贮存条件下考察其稳定性。
2.长期试验:该类样品一般保质期为6个月以上,在说明书规定的条件下考察样品稳定性。
3.加速试验:该类样品一般保质期为2年,为缩短考察时间,可在加速条件下进行稳定性试验,在加速条件下考察样品的感官、化学、物理及生物学方面的变化。
二、试验要求
(一)样品分类。
1.普通样品。对贮存条件没有特殊要求的样品,可在常温条件下贮存,如固体类样品(片剂、胶囊剂、颗粒剂、粉剂等);液体类样品(口服液、饮料、酒剂等)。
2.特殊样品。对贮存条件有特殊要求的样品,如益生菌类、鲜蜂王浆类等。
(二)样品批次、取样和用量。应符合现行法规,满足稳定性试验的要求。
(三)样品包装及试验放置条件。稳定性试验的样品所用包装材料、规格和封装条件应与产品质量标准、说明书中的要求一致。
1.普通样品。加速试验应置于温度37±2℃、相对湿度RH75±5%、避免光线直射的条件下贮存3个月。
短期试验、长期试验应在说明书规定的储存条件下贮存,贮存时间根据产品质量标准及说明书声称的保质期而定。
2.特殊样品。在说明书规定的贮存条件下贮存。
(四)试验时间。稳定性试验中应设置多个考察时间点,其考察时间点应根据对样品的性质(感官、理化、生物学)了解及其变化的趋势设定。
1.普通样品。长期试验一般考察时间应与样品保质期一致,如保质期定为2年的样品,则应对0、3、6、9、12、18、24个月样品进行检验。0月数据可以使用同批次样品卫生学试验结果。
加速试验一般考察时间为3个月,即对放置0、1、2、3个月样品进行考察。0月数据可以使用同批次样品卫生学试验结果。
2.特殊样品。在说明书规定的贮存条件下进行考察。保质期在3个月之内的,应在贮存0、终月(天)进行检测;保质期大于3个月的,应按每3个月检测一次(包括贮存0、终月)的原则进行考察。
(五)考察指标。应按照产品质量标准规定的方法,对申请人送检样品的卫生学及其与产品质量有关的指标在保质期内的变化情况进行的检测。
(六)检测方法。应按产品质量标准规定的检验方法进行稳定性试验考察指标的检测。
三、结果评价
保健食品稳定性试验结果评价是对试验结果进行系统分析和判断,检测结果应符合产品质量标准规定。
(一)贮存条件的确定。应参照稳定性试验研究结果,并结合保健食品在生产、流通过程中可能遇到的情况,同时参考同类已上市产品的贮存条件,进行综合分析,确定适宜的产品贮存条件。
(二)直接接触保健食品的包装材料、容器等的确定。一般应根据保健食品具体情况,结合稳定性研究结果,确定适宜的包装材料。
(三)保质期的确定。保健食品保质期应根据产品具体情况和稳定性考察结果综合确定。采用短期试验或长期试验考察产品质量稳定性的样品,总体考察时间应涵盖所预期的保质期,应以与0月数据相比无明显改变的最长时间点为参考,根据试验结果及产品具体情况,综合确定保质期;采用加速试验考察产品质量稳定性的样品,根据加速试验结果,保质期一般定为2年;同时进行了加速试验和长期试验的样品,其保质期一般主要参考长期试验结果确定。
- 产品技术要求
1.保健食品产品技术要求常见问题及注意事项
产品技术要求是保障保健食品质量可控的重要技术资料,也是保健食品注册证书附件的重要组成部分。《保健食品注册与备案管理办法》规定了保健食品产品技术要求的主要内容,《保健食品注册审评审批工作细则(2016年版)》《保健食品注册申请服务指南(2016年版)》等规范性文件进一步明确了各项内容的具体要求。但是,在审评过程中,我们发现申请人提交的产品技术要求材料质量不高,问题较多,极大地影响了审评工作效率。
为进一步提高申请材料质量,提升工作效率,我们将产品技术要求常见问题和注意事项进行了汇总,供注册申请人借鉴。
一、常见问题及注意事项
(一)注册信息系统填报的产品技术要求与纸版资料不一致。请按照最终确定版本,认真、逐项填写产品技术要求内容。产品技术要求电子版应为文本格式,请勿提交PDF、图片、链接等格式文件。
(二)延续、变更、转让等注册申请,提交的产品技术要求内容与原注册内容不一致。请根据原批准证书及附件、注册申请材料,按照新的规定,完善产品技术要求。
(三)擅自修改产品技术要求未发补内容。补充资料中需提交产品技术要求的,不要擅自修改审评意见未涉及内容,同时产品技术要求电子版与纸版内容保持一致。
(四)其他常见问题,主要包括:
1.【生产工艺】项
(1)除首次申报产品(受理编号为国食健申),其余申报类型产品生产工艺主要流程应与原批件保持一致,同时应当在主要关键工艺后以括号标注关键工艺参数。
(2)提取关键工艺参数应包括溶剂、溶剂量、温度、次数、时间等。例如:分别加6、6、8倍量70%乙醇回流提取3次,每次2h。属混合提取的,简述主要提取过程。
(3)提取后干燥参数应包括方法、温度。例如:喷雾干燥(进风温度160~180℃,出风温度70~80℃)、减压干燥(50℃,-0.08MPa)等。
(4)灭菌应提供原料、方法及参数。例如:辐照灭菌(人参,60Co,5KGy)、湿热灭菌(121℃,30min)等。
(5)发酵参数应包括培养基组成、菌种、温度、时间、pH、终止发酵方法等。
(6)涉及精制工艺的,需要列出精制工艺过程,例如:大孔吸附树脂型号、前处理、吸附方法、洗脱方法等。
2.【直接接触产品包装材料的种类、名称及标准】
(1)应提供与原注册资料、送检样品及检验报告一致的直接接触产品包装材料的种类、名称及标准。
(2)直接接触产品包装材料执行标准为企业标准的,应提供企业标准全文,并以表格形式表示。
3.【感官要求】
(1)状态项应包括杂质描述。
(2)软胶囊应分别对囊皮及内容物的色泽、性状进行描述,硬胶囊无需对囊壳色泽进行描述。
(3)包衣片剂应分别对包衣及片芯的色泽进行描述。
4.【理化指标】
(1)属性名为颗粒的,参照《中华人民共和国药典》中“颗粒剂”的规定制定粒度、溶化性指标,并检测三批产品粒度、溶化性卫生学。属固体饮料的,按照固体饮料国家标准执行并修改属性名。
(2)属性名为含片的,应按《中华人民共和国药典》中“片剂”的规定制定溶化性指标,并检测三批产品溶化性稳定性。属糖果等的,按照糖果国家标准执行并修改属性名。
(3)酒剂应按照国家标准限量要求,制定甲醇、氰化物指标(注明以100%酒精度计)。
5.【微生物指标】
应符合GB 16740-2014《食品安全国家标准保健食品》的规定。原注册申请或批准证书内容与现行国家标准冲突的,应当进行相应调整,使之符合现行国家标准的规定。
6.【标志性成分指标】
(1)注册申请或批准证书内容为“《保健食品检验与评价技术规范》(2003年版)”的,列出检验方法全文,并根据产品具体情况对不明确的方法内容(如样品前处理等)进行细化并提交研究报告。无需细化明确的,提交说明。
(2)引用的国家标准有多个检测方法的,应当明确检测方法为第几法。例如:应明确钙的检测方法为第几法,GB 5009.92中“第二法EDTA滴定法”。
7.【装量或重量差异指标/净含量及允许负偏差指标】
(1)《中华人民共和国药典》“制剂通则”项下有相应要求的产品剂型,装量或重量差异指标应符合相应剂型的规定。例如:应符合《中华人民共和国药典》“制剂通则”项下“胶囊剂”的规定。
(2)普通食品形态产品应检测并制定净含量及允许负偏差指标,应按最小销售包装制订净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF1070)规定。例如:净含量为50g/盒,允许负偏差为9%。
(3)粉剂应制订净含量及允许负偏差指标。属散剂、颗粒剂等的,应按照《中华人民共和国药典》“制剂通则”项下相应要求制订装量或重量差异指标,并相应修改产品属性名。
8.【原辅料质量要求】
(1)原辅料名称应与【原料】【辅料】项保持一致。
(2)原辅料符合国家相关标准的,应提供正确的现行有效版本的标准号及标准名称。
(3)无国家相关标准的,应参考《保健食品注册申请服务指南》5.2.2.4(5)制定原辅料质量要求,包括原料名称(动植物类包括拉丁学名)、制法(包括主要生产工序、关键工艺参数等)、组成、提取率(得率)、感官要求、一般质量控制指标、污染物、农药残留量、功效成分或标志性成分、微生物等。
(4)提取物质量要求应按《保健食品注册申请服务指南》11.2.1制定,包括原料来源(动植物类包括拉丁名称)、制法(提取溶剂、溶剂量、温度、时间、次数;干燥方法、温度;灭菌方法、参数等)、提取率(范围)、感官要求、一般质量控制指标、污染物指标、农药残留量、标志性成分指标、微生物指标等。
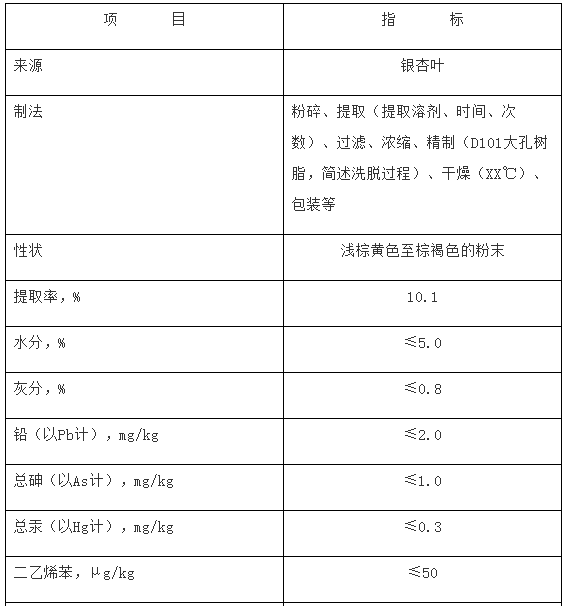
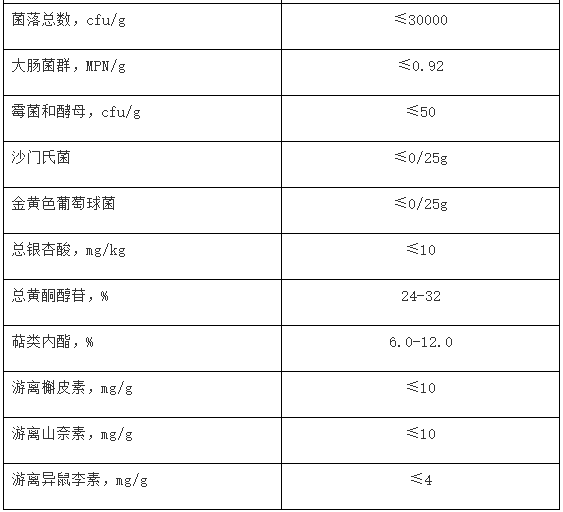
(5)银杏叶提取物质量要求应包括原料来源(包括拉丁名称)、制法、性状、水分、灰分、得率、铅、总砷、总汞、加工助剂残留(根据制法,如大孔吸附树脂、乙酸乙酯残留等)、微生物(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)、总银杏酸(≤10mg/kg)、总黄酮醇苷(以范围值标示)、萜类内酯(以范围值标示)、游离槲皮素(≤10mg/g)、游离山柰素(≤10mg/g)、游离异鼠李素(≤4mg/g)等指标。并按银杏叶提取物原料质量标准及《国家食品药品监督管理总局关于发布银杏叶药品补充检验方法的公告(2015年第66号)》的要求,提供银杏叶提取物原料自检报告。
(6)原辅料质量要求应引用具有专属性的质量标准,而非通用标准或使用标准。若无相关标准,应参考《保健食品注册申请服务指南》5.2.2.4(5)制定。例如:苹果粉不应引用GB/T 29602《固体饮料》,大豆油不应引用GB 2716《植物油》,某食品添加剂不应引用GB 2760《食品添加剂使用标准》,复配原料不应引用GB 26687《食品安全国家标准复配食品添加剂通则(含第1号修改单)》。
(7)明确空心胶囊、淀粉种类。例如:明胶空心胶囊应符合《中华人民共和国药典》的规定,玉米淀粉应符合《中华人民共和国药典》的规定。
(8)对于有国家相关标准和现行规定的原辅料,质量要求应不得低于国家相关标准和现行规定。例如:氯化高铁血红素质量要求应参照《食品安全国家相关标准营养强化剂氯化高铁血红素(征求意见稿)》制定。硫酸软骨素钠质量要求中应明确原料来源,猪软骨来源的应符合《中华人民共和国药典》规定;其他动物软骨来源的,除比旋光度外应符合《中华人民共和国药典》规定。山楂质量要求中应制定展青霉素指标。
2.以银杏叶提取物为原料的产品,应提交的申报资料
根据总局要求,为进一步强化审评与监管的衔接,从2016年3月1日起评审的以银杏叶提取物为原料的产品,包括新申报、再注册、技术转让和变更产品,除符合现行法规标准外,注册申请人还应按以下要求提供资料:
一、将银杏叶提取物原料质量标准纳入产品技术要求。银杏叶提取物原料质量标准应包括:来源、制法、提取率、性状、水分、灰分、铅(≤2.0mg/kg)、总砷(≤1.0mg/kg)、总汞(≤0.3mg/kg)、加工助剂残留(根据制法,如大孔吸附树脂、乙酸乙酯残留等)、微生物(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)、总银杏酸(≤10mg/kg)、总黄酮醇苷(以范围值标示)、萜类内酯(以范围值标示)、槲皮素(≤10mg/g)、山柰素(≤10mg/g)、异鼠李素(≤4mg/g)等。
二、按银杏叶提取物原料质量标准及《国家食品药品监督管理总局关于发布银杏叶药品补充检验方法的公告(2015年第66号)》的要求,提供银杏叶提取物原料自检报告。
3.保健食品益生菌类标志性成分检测方法的选择和确认
为进一步明确保健食品益生菌类标志性成分检测方法的研发和审评要求,我中心组织专题研讨会,对相关审评问题进行了研究。现将有关情况发布如下,供保健食品注册申请时参考。
鉴于现行的益生菌检测方法国家标准和国际标准基本能够满足保健食品益生菌检测需要,且国家标准和国际标准检测方法稳定、复现、适用,目前暂不将益生菌类标志性成分检测方法学研究资料作为强制性要求,但注册申请人选择和确认的检测方法应符合以下国家标准或国际标准:
(一)检测菌种在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内的益生菌产品,检测方法必须采用GB 4789.34或GB 4789.35规定的方法。
(二)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且检测方法无法采用GB 4789.34或GB 4789.35规定方法的产品,可采用AOAC(Association Of Official Analytical Chemists)微生物检验方法体系、USDA(United States Department of Agriculture)微生物检验方法体系、IDF(International Dairy Federation)微生物检验方法体系、FDA Bacteriological Analytical Manual(BAM)及ISO 16140规定的方法。
(三)检测菌种不在现行《可用于保健食品益生菌菌种名单》及《可用于食品的菌种名单》内,且采用自行制定的检测方法的产品,应提供检测方法选择和确定的依据,与上述国际微生物检验方法体系相应方法的三批产品检测结果比对。
4.保健食品含片与颗粒剂溶化性指标检测、标志性成分或功效成分检测方法学研究资料
一、含片与颗粒剂的溶化性指标
含片与颗粒剂中溶化性指标、名称一致,但其测定方法与考察目的不同。含片的溶化性按“崩解时限检查法”检查,考察产品在规定时限内不得崩解,验证物质释放方式与剂型设计的相符性;保健食品常见的颗粒剂包括可溶性颗粒与混悬型颗粒,可溶性颗粒溶化性检查方法为:加热水 200mL, 5分钟内应全部溶化或轻微浑浊,不得有异物或焦屑,主要目的是检查其是否混有不溶性异物等。
鉴于检测目的不同,保健食品技术审评中,含片的溶化性指标作为产品稳定性重点考察指标,颗粒剂的溶化性指标作为产品非稳定性考察指标,混悬型颗粒暂不要求制订溶化性指标。
二、标志性成分或功效成分检测方法学研究资料
根据产品检测方法来源,应提交产品标志性成分或功效成分检测方法学研究资料,明确检测方法建立的研究过程,验证检测方法的准确性、重现性和适用性。还应按《保健食品注册申请服务指南》(以下简称《指南》),提交研究人员、研究时间、研究地点等溯源性资料。属委托研究的,还应提交委托研究合同(协议)等。
(一)引用国家相关标准方法的,考虑方法建立时已进行方法学研究,不要求提供检测方法建立的研究资料,但应参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察检出限、精密度、准确度、线性范围。
(二)检测方法对国家相关标准方法的样品前处理、检测条件等内容进行修订的,重点对方法修订部分进行方法学研究,提供研究资料,并参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察方法的检出限、精密度、准确度、线性范围。
(三)申请人自行制订检测方法的,应提供全部的方法学建立研究报告,参照GB/T 5009.1《食品卫生检验方法 理化部分 总则》,考察检出限、精密度、准确度、线性范围,并考察所建立方法的专属性与耐用性。
三、标准执行版本更替
对于因标准执行版本更替,引起的标准名称或标准号变化,应根据检测方法变化情况,提交申请材料。
(一)不涉及方法原理与操作步骤变化的,可不再要求申请人进行相关项目的测定。
(二)不能确定或已确定检测方法发生原理或操作步骤变化的,要求申请人提供三批产品新老方法检测比对结果。
四、执行《食品安全国家标准 保健食品》(GB 16740)涉及的指标检测
对于执行GB 16740,涉及产品技术要求调整和检测报告要求,应根据指标调整的不同,提交申请材料。
(一)因执行GB 16740,放宽指标限值或减少微生物指标要求的,考虑到原已对相关指标进行了检测,且符合现行 GB16740规定,可不再要求提供相关指标检测报告。
(二)因执行GB 16740,需对指标限值从严要求的,应提供具有法定资质的检验机构出具的三批产品该指标检验报告。
(三)因执行GB 16740,需修订大肠菌群检测方法的,应提供三批产品大肠菌群自检报告。
(四)因执行GB 16740,确需单独提交污染物和微生物指标变更注册申请的,严格按照《关于实施<食品安全国家标准 保健食品>有关问题的公告》(2015年第104号)和《关于实施<食品安全国家标准 保健食品>有关问题的复函》(食药监食监三便函〔2015〕216号)规定执行。
- 产品说明书
1.功能性保健食品的产品说明书中标志性成分及含量的标示值的确定要求
按《保健食品注册申请服务指南》的要求,产品说明书中标志性成分及含量的标示值以产品技术要求中指标最低值标示。如某产品的技术要求中标志性成分含量为总黄酮≥900mg/100g,说明书中应标示为“每100g含:总黄酮900mg”;如某产品的技术要求中标志性成分含量为总黄酮500-900mg/100g,说明书中应标示为“每100g含:总黄酮500mg”。
2.酒剂产品标示产品说明书的注意事项要求
酒剂产品应在产品说明书注意事项中标示“对酒精过敏者慎用;本品不宜超量食用,不宜与其他酒类同时食用”。
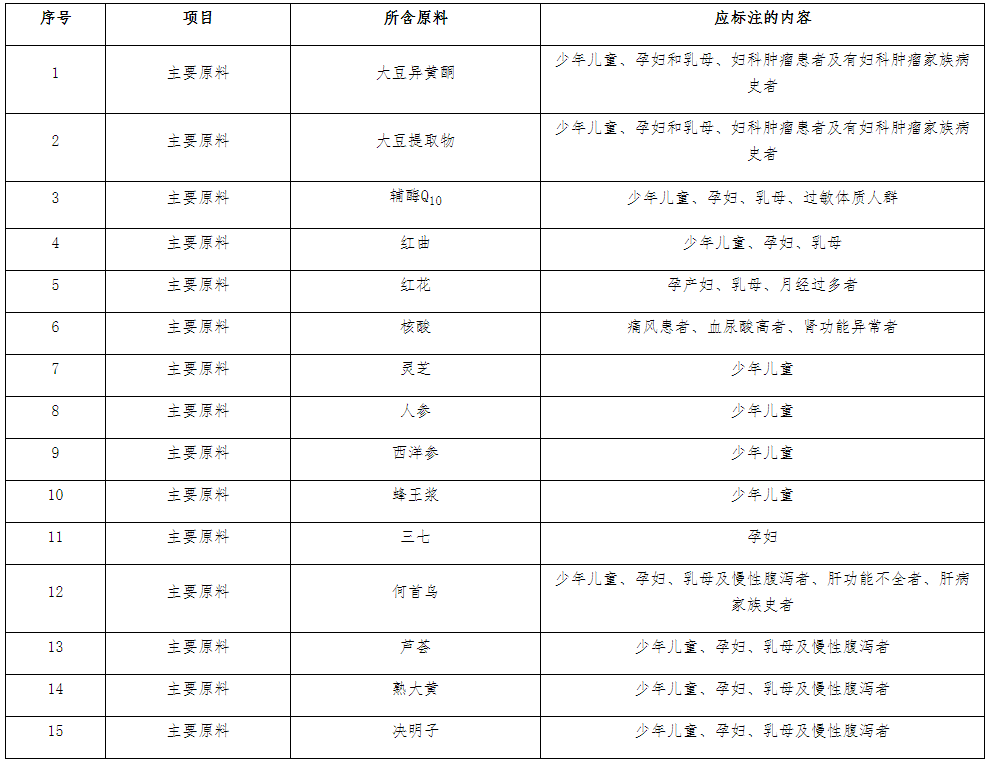
3.不同原料的保健食品,不适宜人群标注要求
不同原料组方的保健食品,因原料本身的限制,其不适宜人群应当且不限于以下标注内容:
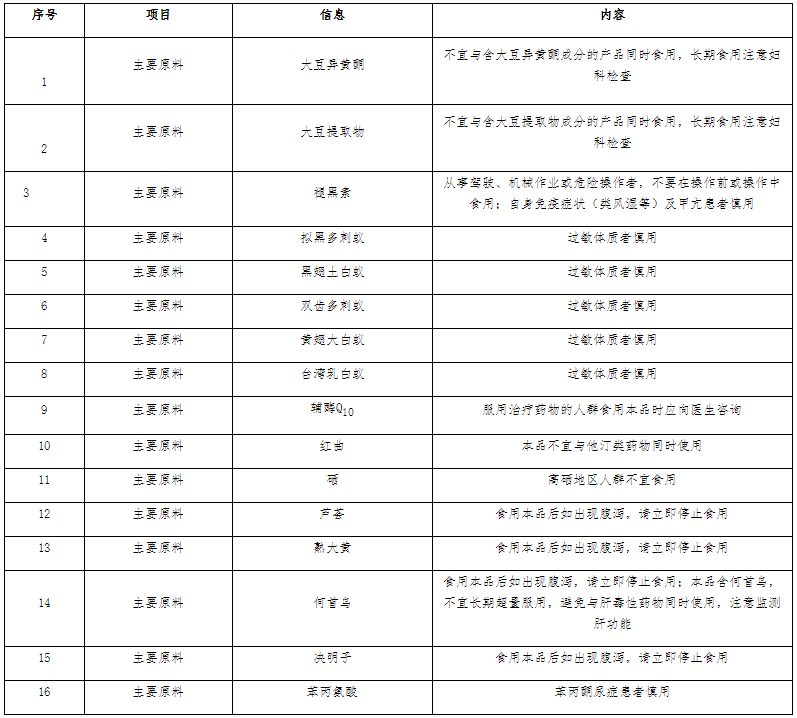
 4.不同原料的保健食品,注意事项标注要求
4.不同原料的保健食品,注意事项标注要求
不同原料组方的保健食品,因原料本身的限制,其注意事项应当且不限于以下标注内容:
 共性问题解答
共性问题解答
一、涉及配方、原辅料及其他证明性资料,多次补充资料仍不规范或不完整时,应该特别关注的问题
1.新产品、再注册、变更、技术转让等各类产品,剂型为明胶空心胶囊或使用明胶制软胶囊的,均应提供明胶空心胶囊或明胶的供货证明、质量检验报告、质量标准、生产企业资质证明;
2.技术转让申报资料应同时加盖转让方和受让方的印章;
3.产品申报审评过程中,申请人名称或地址发生变更,应主动以书面形式提交资料,清晰的注明相关变更事项,并提供变更后的营业执照及工商管理部门出具的证明文件;
4.产品申报审评过程中,申请人自行提出变更产品名称,应以书面形式提交资料,清晰的注明变更产品名称的申请和理由;
5.应按国家相关标准或生产实际所用原辅料提供规范的原辅料名称,如按照 GB2760“甘露醇”应规范为“ D-甘露糖醇”、“山梨醇”应规范为“山梨糖醇”;
6.有多个化合物来源的维生素原料,应具体注明化合物名称,如维生素 B1原料应注明为盐酸硫胺素或硝酸硫胺素;
7.使用复配加工制成的原辅料未提供其具体组成及用量,如维生素 E微囊、营养素预混料、包衣剂等。
二、保健食品检验报告内容更正有何要求?
保健食品注册检验机构的检验报告一经出具,不得更改。检验报告内容有误的,由申请人提供相关情况说明;需要注册检验机构进行说明的,由注册检验机构提供相关情况说明。
三、按审评意见需补充材料的新产品注册和延续注册(再注册)申请,产品标签说明书以及产品技术要求应补充完善哪些内容?
根据《关于保健食品注册审评审批工作过渡衔接有关事项的通告》(16年第172号),已受理属于注册管理范围的新产品注册和延续注册(再注册)申请,申请人应按照《保健食品注册审评审批工作细则》(2016年版)(以下简称《细则》)及《保健食品注册申请服务指南》(2016年版)(以下简称《指南》)等相关规定完善产品标签说明书以及产品技术要求。
一、产品标签说明书
按照《细则》及《指南》等相关规定,补充完善产品标签说明书内容,补充提供修订说明以及规范的标签说明书样稿。
【原料】按配方材料列出全部原料。各原料顺序按其在产品中的用量,由大到小排列。经辐照的原料,应在原料名称后标注“(经辐照)”。
【辅料】按配方材料列出全部辅料。各辅料顺序按其在产品中的用量,由大到小排列。经辐照的辅料,应在辅料名称后标注“(经辐照)”。
【功效成分或标志性成分含量】应包括成分名称及含量。应与产品技术要求中功效成分或标志性成分指标名称一致,以产品技术要求中指标最低值为标签说明书标示值。(营养素补充剂产品除外)
【适宜人群】应为与安全性、保健功能等科学依据相符的食用安全、有明确功能需求、适合本产品的特定人群。
【不适宜人群】应为适宜人群范围中应当除外的特定人群、现有科学依据不足以支持该产品适宜的婴幼儿、孕妇、乳母等特殊人群,以及现行规定明确应当标注的特定人群。暂无法确定不适宜人群的,应明确注明“限于目前科学研究水平,该产品暂未发现明确的不适宜人群,将根据收集到的食用安全信息,予以完善补充”。
【保健功能】应经研发综合确定,符合保健功能声称管理的相关要求。
【食用量及食用方法】应与产品配方配伍及用量的科学依据、安全性和保健功能试验评价材料等相符。
【规格】应为最小制剂单元的重量或者体积(不包括包装材料;胶囊剂指内容物;糖衣片或丸指包糖衣前的片芯或者丸芯),应与产品食用量及食用方法相匹配。酒类产品应注明酒精度。
【贮藏方法】应根据产品特性、稳定性试验等综合确定。贮藏方法为冷藏等特殊条件的,应列出具体贮藏条件。
【保质期】应经研发综合确定。以“××月”表示,不足月的以“××天”表示。
【注意事项】应注明“本品不能代替药物。适宜人群外的人群不推荐食用本产品”。
必要时还应根据法规规定、研发情况、科学共识以及产品特性增加相应注意事项。
备注:
1、【功效成分或标志性成分含量】项,应以重新确认提交的技术要求中相应指标的最低值标示(营养素补充剂产品除外)。
2、【适宜人群】、【不适宜人群】项内容未按《指南》要求确定的,应按《指南》要求修改完善。修订后的内容较原确认提交的内容扩大了适宜人群范围或缩小了不适宜人群范围的,应说明理由并提供相应的科学证据。
3、【注意事项】内容应准确完备,需增加的内容应表述详明。
二、产品技术要求新增内容
1、【生产工艺】项
应以文字形式描述主要生产工艺,包括主要工序、关键工艺参数或参数合理范围等。非关键工艺的工艺参数可不提供。关键工艺是指产品生产过程中,对产品质量安全或保健功能有直接影响,不随着工艺规模、生产设备等客观变化必须进行参数调整的工艺。如:提取精制、干燥等工序的技术参数或参数合理范围,灭菌的方法及具体参数等。
示例1:本品经提取(提取溶剂、时间、次数、温度)、精制(D101大孔树脂,简述洗脱过程)、浓缩、真空干燥(××℃)、配制、过滤、热压灭菌(121℃,30min)、灌装、包装等主要工艺加工制成。
示例2:本品经混合、制粒、压片、包装等主要工艺加工制成。
2、【直接接触产品包装材料的种类、名称及标准】项
应以文字形式描述经研发确定的直接接触产品包装材料的种类、名称及标准。直接接触产品的包装材料的名称、种类、标准号和标准文本应完整,选择依据应符合现行规定。
示例:钠钙玻璃药瓶应符合《钠钙玻璃模制药瓶》(YBB00272002-2015);铝防伪瓶盖应符合《中华人民共和国包装行业标准 铝防伪瓶盖》(BB/T 0034-2006)。
3、【装量或重量差异指标/净含量及允许负偏差指标】项
应以文字形式描述装量或重量差异指标(净含量及允许负偏差指标)。《中华人民共和国药典》(以下简称《中国药典》)“制剂通则”项下有相应要求的产品剂型,标注“装量(或重量)差异指标应符合《中华人民共和国药典》中制剂通则项下XXXX的规定。
示例1(XXX片):重量差异指标应符合《中华人民共和国药典》中“制剂通则”项下片剂的规定。
示例2(XXX胶囊):装量差异指标应符合《中华人民共和国药典》中“制剂通则”项下胶囊剂的规定。
普通食品形态产品应制定净含量及允许负偏差指标,指标应符合《定量包装商品净含量计量检验规则》(JJF 1070)规定。
示例(XXX饮料):净含量为250mL/瓶,允许负偏差为9mL;150mL/瓶,允许负偏差为4.5%。
4、【原辅料质量要求】项
质量要求为国家标准、地方标准、行业标准的,应列出标准号;符合国家标准、地方标准、行业标准,且部分指标应同时符合企业标准的,应列出标准号或规范性文件的标题文号,同时以文字形式列出企业标准的指标项目及指标值。
为企业标准的,应以列表形式列出指标项目及指标值。无适用的国家标准、地方标准、行业标准的原料,还应列出主要生产工序和关键工艺参数。
对于以提取物为原料的产品,还应按《指南》完善提取物质量要求,包括原料来源(对动植物品种有明确要求的,应明确其具体品种,必要时写明原植物拉丁学名)、制法(包括主要生产工序、关键工艺参数等)、提取率(得率)、感官要求、一般质量控制指标(如水分、灰分、粒度等)、污染物指标(铅、总砷、总汞、提取溶剂残留等)、农药残留量、标志性成分指标(难以定量测定的应当制定专属性定性鉴别指标)、微生物指标(包括菌落总数、大肠菌群、霉菌和酵母、金黄色葡萄球菌、沙门氏菌)等。内容有缺项难以制定或无需制定的,原因应合理。
示例:银杏叶提取物
 三、其它注意事项
三、其它注意事项
1、补充提供的产品技术要求中原已认可内容不得更改,新增内容应与原已认可的生产工艺、企业标准、直接接触产品的内包装材料等相关内容保持一致。
2、产品标签说明书电子版本提交
登录市场监督管理总局食品审评中心网站(http://www.cfe-samr.org.cn/),上传规范完善后的标签说明书样稿,同时提交加盖申请人公章的标签说明书样稿、修订说明等补充资料。(保健食品安全部)
四、对同一产品是否可以同时提出多个事项的变更注册申请
2017 年 1 月 1 日起,申请人对同一产品可以同时提出多个事项的变更注册申请。同时提出时,如果该产品已有正在审评流程中的变更事项,申请人应一并提供关于该变更事项及其受理编号的书面说明;如果该变更事项是在 2016 年 12 月 31 日前申请受理的,则属于过渡期产品,申请人应在该变更事项办理完结后再提出其他事项的变更注册申请。
五、进口保健食品延续注册生产销售证明文件应该提交的材料内容
一、根据《保健食品注册与备案管理办法》,保健食品延续注册申请需提供经省级食品药品监督管理部门核实的注册证书有效期内保健食品的生产销售情况。
二、对于无法提供省级食品药品监管部门核实的进口保健食品生产销售情况证明的,注册申请人应提交书面的生产销售情况说明,并附盖公章或法人代表签字的经营许可证、进口货物报关单和销售发票复印件。
六、酒类保健食品受试物应如何处理?
含乙醇的保健食品,受试物乙醇含量应小于或等于15%,否则应对受试物中乙醇含量进行调整。
1、在按其推荐量设计试验剂量时,如超过动物最大灌胃容量,可以进行浓缩。乙醇浓度低于15% (v/v)的受试物,浓缩后的乙醇应恢复至受试物定型产品原来的浓度。乙醇浓度高于15%的受试物,浓缩后应将乙醇浓度调整至15%,并将各剂量组的乙醇浓度调整一致。
2、不需要浓缩的受试物乙醇浓度>15%时,应将各剂量组的乙醇浓度调整至15%。在调整受试物的乙醇浓度时,应使用该保健食品的酒基。
3、进行果蝇试验时应将乙醇去除。
七、人体试食功能试验中容易疏漏的问题有哪些?
1、应根据受试物的配方组成、保健功能、适宜人群合理选择受试者。如保健功能为“改善记忆”、适宜人群范围为“中老年人”的产品,选择儿童青少年作为受试者显然是不适宜的。
2、报告中应分别记录人体试食试验前及试验后人数,并要求注明脱离率。
3、试验组间年龄、性别、社会状况构成、身体状况以及试验开始时各功能指标均衡可比,在提交的报告中应有组间均衡性检验表,证明组间的均衡可比。
4、便常规指标在人体试食试验中被遗漏的频率较高。
5、膳食及运动状况调查及评价应采用规范的方法进行。
6、试验报告应附伦理委员会的审查证明文件。
7、受试者在进行减肥功能人体试食试验期间,必须保持每天正常的膳食需要。
八、保健食品注册证书由多方注册人共同持有变为单方持有应如何申请
九、原料和主要辅料相同、口味或颜色不同的保健食品技术转让涉及的有关试验有何要求?
对原料和主要辅料相同、口味或颜色不同的保健食品,如在新产品注册时未开展安全性毒理学评价试验和功能学评价试验,申请人在申请技术转让产品注册时,应当补做该两类试验。
十、保健食品申报中使用EDTA-铁应注意哪些问题?
近来企业对于以乙二胺四乙酸铁钠(EDTA-铁钠)为原料生产的保健食品的申报存有较多疑问。例如,EDTA-铁钠可申报的功能、用量、配伍等问题。
美国FDA已将EDTA-铁钠列入食品添加剂名单中,我国也已将其列入食品添加剂使用卫生标准(GB2760-1996)(2002年增补品种)的营养强化剂名单中,可用于酱油。由于EDTA-铁钠是一种强螯合剂,在体内可络合其它二价阳离子,并对二价阳离子依存酶具有干扰作用, EDTA-铁钠与中药配伍也缺少科学文献依据支持。根据现有资料,保健食品评审专家对其食用安全性尚有争议。因此目前申报此类产品应注意:
1、EDTA-铁不宜作为营养素补充剂铁的来源;
2、申报功能:以EDTA-铁为原料的保健食品,申报的保健功能暂限定为促进排铅和改善营养性贫血;
3、用量:参考食品营养强化剂使用卫生标准(GB14880)的规定,成人EDTA-铁的每日食用量不超过92mg(折算成铁为12 mg),少年儿童减半;
4、鉴于EDTA-铁与中药配伍的机理不清,原则上不提倡二者配伍(阿胶、红枣等具有补血功能的原料除外)。
十一、文献依据中所提供的文献,同一作者或科研机构的相同内容论文可否算多篇文献
发表单位或主要作者相同、且主要内容相同的不同文献应视为1篇,发表于同一著作、不同章节的文献应视为1篇。
十二、对于保健食品注册人名称、地址变更申请,工商行政管理部门不再向企业出具相关证明文件怎么办?
近期,为贯彻落实国务院办公厅《关于简化优化公共服务流程方便基层群众办事创业的通知》要求,部分省份工商行政管理部门采取减“证”便民改革措施,取消了出具企业名称、地址已变更证明文件的办理业务,企业可自行在国家企业信用信息公示系统中查询和打印相关变更信息。如遇上述情形的企业,在提出保健食品注册人名称、地址变更申请时,需工商行政管理部门出具的注册人名称、地址已经变更的证明文件,可以国家企业信用信息公示系统中查询到的完整企业信用信息公示报告打印件替代,并加盖注册人公章,同时提供其信息公示系统查询网址。
新营养留言互动
您的电话不会被公开。 必填项已用 * 标注
相关热词搜索:
上一篇:关于公开征求叶黄素、2'-岩藻糖基乳糖、d-核糖、维生素K等11种食品添加剂新品种意见
下一篇:箭牌,森永,星巴克这期食品饮料流行的风味是,肉桂?板栗?还是南瓜?
新营养峰会/活动
新营养热门资讯
共晶技术:让营养素步入埃米时代
XINGRAPHIC · 09-11
11月6-7日广州新营养趋势大会!30+演讲、2
风信社 · 09-08
当“造物”成为可能,人类营养健康产业将迎
XINGRAPHIC · 07-07
新营养周报 | 农夫山泉上新蓝靛果混合汁
数据 / 观察 · 01-06