新植物资讯
新植物 | 研究高生物利用度类姜黄素对重度抑郁症的辅助治疗功效
2020-07-02 00:41 来源:新营养
 摘要:当前的医疗手段对重度抑郁症(MDD)的作用很有限,并且长期使用会伴随多种副反应。类姜黄素是非常安全并且具有多重功能的植物药,在多项实验模型中显示出具有缓解抑郁症状的功效。本文研究的是类姜黄素在标准抗抑郁疗法的基础上作为外加一味对抗重度抑郁症的人体功效。受试者共111名,分为单独使用标准抑郁疗法组和标准抗抑郁疗法加类姜黄素-胡椒碱组,测试周期为6周。通过受试者精神状态的变化来检测功效,指标有医院焦虑抑郁量表(HADS)和白氏抑郁量表Ⅱ(BDI-Ⅱ)。在实验结束后发现2组的BDI-Ⅱ和HADS的总量表和分量表得分均有下降。而相较对照组,类姜黄素组HADS 总分和焦虑分量表得分减少更显著(p<0.001)。同样的,相比对照组,类姜黄素组BDI-Ⅱ总得分和身体、认知分量表得分也有更显著减少(p<0.001)。用标准抑郁疗法复配类姜黄素-胡椒碱可能成为一种安全、有效的治疗重度抑郁症疗法。
关键词:姜黄素;胡椒碱;抑郁;焦虑;临床研究
介绍
重度抑郁症(MDD)是最常见的精神疾病(WHO,2008),且通常会严重影响个体生活质量,因为其症状有情绪反复,睡眠问题,失去动力,缺乏兴趣,容易疲劳,注意力不能集中甚至自杀倾向。当前经临床验证治疗重度抑郁症的医学方法主要是调节血清素和去甲肾上腺素的神经传递。但有相当一部分患者对常规抗抑郁药物不起反应(Nemeroff, 2007)。此外,现有的抗抑郁药物通常会导致副反应,重度抑郁症是一个会复发的慢性疾病,这种副反应会导致患者不耐受或药效不好。所以本文将进行一项新的实验,在提高抗抑郁药物功效的同时提高其耐受性。而天然药物由于其安全、多重功效、名族药理学和传统应用等因素引起了研究者的兴趣。
类姜黄素,天然多酚物质,是著名植物香料--姜黄的颜色和大部分功效原因所在。经过近二十年的科学研究,类姜黄素已成为最广泛研究的多酚类成分。植物姜黄中的类姜黄素成分大约占5%,而类姜黄素成分主要包括姜黄素(65-80%),去甲氧基姜黄素(15-25%)和二去甲氧基姜黄素(5-15%)。类姜黄素拥有多重药用功效,且被证实可以对抗多种疾病(Ganjali et al., 2014; Gupta et al., 2013a, 2013b; Iranshahi et al., 2010; Panahi et al., 2014a; Sahebkar, 2010, 2013, 2014a, 2014b, 2014c; Shehzad et al., 2013a, 2013b)。大部分药用功效是源于类姜黄素的强大抗炎(Panahi et al., 2014b; Shehzad et al., 2013b)和抗氧化作用(Ak and Gulcin, 2008; Panahi et al., 2014c; Sahebkar et al., 2013)。值得注意的是,类姜黄素已在多项不同的实验模型中显示出抗抑郁和焦虑功效(Kulkarni et al., 2008; Wang et al., 2008; Xia et al., 2007; Xu et al., 2005b, 2007; Yu et al., 2002)。类姜黄素抗抑郁的机理可能包括:对抗中枢神经系统内的炎症(Lim et al., 2001)和氧化压力(Samini et al., 2013),提高脑神经因子和海马神经发生(Xu et al., 2007),抑制星形胶质细胞激活(Rajasekar et al., 2013),抑制单胺氧化酶(Xia et al., 2007; Xu et al., 2005b; Yu et al., 2002)和调节神经递质如血清素、去甲肾上腺素和多巴胺(Kulkarni et al., Lin et al., 2011; Xia et al., 2007)。
尽管预临床数据很好,类姜黄素现有的抗抑郁临床研究却很少,本文研究的目的是验证在标准抗抑郁疗法基础上加入高生物利用度类姜黄素对重度抑郁症的缓解功效。
方法
●受试者
本项研究是一项开放标签实验,测试时间为2012年10月至2013年8月。受试者为18-65岁经DSM-Ⅳ标准诊断为重度抑郁的男性和女性。且排除癫痫、重度强迫症、不受控制的甲状腺疾病和对类姜黄素敏感,以及接受精神干预或精神疗法的病人。由伊朗德黑兰Baqiyatallah和Rofeideh医院的精神科招募受试者。
111名受试者达到标准,并接受持续6周的标准抗抑郁治疗(对照组,受试者65名)或标准抗抑郁疗法加类姜黄素-胡椒碱治疗(类姜黄素组,受试者75名)。类姜黄素(C3 Complex®,印度班加罗尔Sami labs公司)每天口服计量为1000mg,并复配10mg胡椒碱(Bioperine®,印度班加罗尔Sami labs公司)提升生物利用度。
每位受试者在实验开始和结束后由经验丰富的精神科医师检测。实验严格遵循赫尔辛基宣言指导,由Baqiyatallah大学医学研究院批准通过实验伦理。并获得所有受试者书面同意书。
●功效测评
本实验中抗抑郁功效主要体现在受试者经精神状态的变化,指标包括医院焦虑抑郁量表(HADS)和白氏抑郁量表Ⅱ(BDI-Ⅱ)。HDAS为受试者自我打分量表,包括2个分量表:焦虑量表(HADS-A)和抑郁量表(HADS-D)(Zigmond and Snaith, 1983)。每个分量表包括7项,总共有4个分值,从0(没有压力)到3(压力最大)。所以,每个分量表最高得分为21分,得分越高意味着焦虑或抑郁的风险越高。之前伊朗研究者对HADS可靠性和有效性研究发现,每个HADS分量表最佳的分界点为6分(Kaviani et al., 2009)。
白氏抑郁量表Ⅱ(BDI-Ⅱ)是另外一项应用很广泛的自我评估打分量表,评估是否抑郁和抑郁程度,包含3个分量表:情感,身体和认知症状。这个量表包含21个抑郁症状,4个分值,从0(没有压力)到3(最大压力)。最高分为63分,得分越高意味着抑郁程度越高。之前伊朗研究者对BDI-Ⅱ可靠性和有效性研究发现,BDI-Ⅱ量表最佳的分界点为15分(Kaviani et al., 2009)。
●数据分析
利用SPSS软件11.5版本进行数据分析(美国伊利诺斯州芝加哥SPSS 公司)。数据以平均值±标准或者百分比表示。两组之间对比和组内对比分别用曼-惠特尼u检验和威尔克科森有符号秩检验。分类变量对比使用卡方检验。双侧检验p值<0.05则认为数据具有统计学意义。
结果
111名受试者完成实验,类姜黄素组61名,对照组50名。对照组有15名受试者因没有跟进而放弃,类姜黄素组有14名受试者放弃,其中9名因没有跟进放弃,3名因胃肠并发症放弃,2名因心跳加速、潮红和肠胃并发症放弃。2组的年龄,性别,体重,婚姻状态和已使用的抗抑郁药物基线数据均具有可比性(p>0.05),见表1。两组基线精神状态的BDI-Ⅱ得分或分量表得分均没有明显差异(p>0.05)。而类姜黄组HADS量表中焦虑基线得分高于对照组(p<0.001),抑郁基线得分没有明显差异(p>0.05)。
摘要:当前的医疗手段对重度抑郁症(MDD)的作用很有限,并且长期使用会伴随多种副反应。类姜黄素是非常安全并且具有多重功能的植物药,在多项实验模型中显示出具有缓解抑郁症状的功效。本文研究的是类姜黄素在标准抗抑郁疗法的基础上作为外加一味对抗重度抑郁症的人体功效。受试者共111名,分为单独使用标准抑郁疗法组和标准抗抑郁疗法加类姜黄素-胡椒碱组,测试周期为6周。通过受试者精神状态的变化来检测功效,指标有医院焦虑抑郁量表(HADS)和白氏抑郁量表Ⅱ(BDI-Ⅱ)。在实验结束后发现2组的BDI-Ⅱ和HADS的总量表和分量表得分均有下降。而相较对照组,类姜黄素组HADS 总分和焦虑分量表得分减少更显著(p<0.001)。同样的,相比对照组,类姜黄素组BDI-Ⅱ总得分和身体、认知分量表得分也有更显著减少(p<0.001)。用标准抑郁疗法复配类姜黄素-胡椒碱可能成为一种安全、有效的治疗重度抑郁症疗法。
关键词:姜黄素;胡椒碱;抑郁;焦虑;临床研究
介绍
重度抑郁症(MDD)是最常见的精神疾病(WHO,2008),且通常会严重影响个体生活质量,因为其症状有情绪反复,睡眠问题,失去动力,缺乏兴趣,容易疲劳,注意力不能集中甚至自杀倾向。当前经临床验证治疗重度抑郁症的医学方法主要是调节血清素和去甲肾上腺素的神经传递。但有相当一部分患者对常规抗抑郁药物不起反应(Nemeroff, 2007)。此外,现有的抗抑郁药物通常会导致副反应,重度抑郁症是一个会复发的慢性疾病,这种副反应会导致患者不耐受或药效不好。所以本文将进行一项新的实验,在提高抗抑郁药物功效的同时提高其耐受性。而天然药物由于其安全、多重功效、名族药理学和传统应用等因素引起了研究者的兴趣。
类姜黄素,天然多酚物质,是著名植物香料--姜黄的颜色和大部分功效原因所在。经过近二十年的科学研究,类姜黄素已成为最广泛研究的多酚类成分。植物姜黄中的类姜黄素成分大约占5%,而类姜黄素成分主要包括姜黄素(65-80%),去甲氧基姜黄素(15-25%)和二去甲氧基姜黄素(5-15%)。类姜黄素拥有多重药用功效,且被证实可以对抗多种疾病(Ganjali et al., 2014; Gupta et al., 2013a, 2013b; Iranshahi et al., 2010; Panahi et al., 2014a; Sahebkar, 2010, 2013, 2014a, 2014b, 2014c; Shehzad et al., 2013a, 2013b)。大部分药用功效是源于类姜黄素的强大抗炎(Panahi et al., 2014b; Shehzad et al., 2013b)和抗氧化作用(Ak and Gulcin, 2008; Panahi et al., 2014c; Sahebkar et al., 2013)。值得注意的是,类姜黄素已在多项不同的实验模型中显示出抗抑郁和焦虑功效(Kulkarni et al., 2008; Wang et al., 2008; Xia et al., 2007; Xu et al., 2005b, 2007; Yu et al., 2002)。类姜黄素抗抑郁的机理可能包括:对抗中枢神经系统内的炎症(Lim et al., 2001)和氧化压力(Samini et al., 2013),提高脑神经因子和海马神经发生(Xu et al., 2007),抑制星形胶质细胞激活(Rajasekar et al., 2013),抑制单胺氧化酶(Xia et al., 2007; Xu et al., 2005b; Yu et al., 2002)和调节神经递质如血清素、去甲肾上腺素和多巴胺(Kulkarni et al., Lin et al., 2011; Xia et al., 2007)。
尽管预临床数据很好,类姜黄素现有的抗抑郁临床研究却很少,本文研究的目的是验证在标准抗抑郁疗法基础上加入高生物利用度类姜黄素对重度抑郁症的缓解功效。
方法
●受试者
本项研究是一项开放标签实验,测试时间为2012年10月至2013年8月。受试者为18-65岁经DSM-Ⅳ标准诊断为重度抑郁的男性和女性。且排除癫痫、重度强迫症、不受控制的甲状腺疾病和对类姜黄素敏感,以及接受精神干预或精神疗法的病人。由伊朗德黑兰Baqiyatallah和Rofeideh医院的精神科招募受试者。
111名受试者达到标准,并接受持续6周的标准抗抑郁治疗(对照组,受试者65名)或标准抗抑郁疗法加类姜黄素-胡椒碱治疗(类姜黄素组,受试者75名)。类姜黄素(C3 Complex®,印度班加罗尔Sami labs公司)每天口服计量为1000mg,并复配10mg胡椒碱(Bioperine®,印度班加罗尔Sami labs公司)提升生物利用度。
每位受试者在实验开始和结束后由经验丰富的精神科医师检测。实验严格遵循赫尔辛基宣言指导,由Baqiyatallah大学医学研究院批准通过实验伦理。并获得所有受试者书面同意书。
●功效测评
本实验中抗抑郁功效主要体现在受试者经精神状态的变化,指标包括医院焦虑抑郁量表(HADS)和白氏抑郁量表Ⅱ(BDI-Ⅱ)。HDAS为受试者自我打分量表,包括2个分量表:焦虑量表(HADS-A)和抑郁量表(HADS-D)(Zigmond and Snaith, 1983)。每个分量表包括7项,总共有4个分值,从0(没有压力)到3(压力最大)。所以,每个分量表最高得分为21分,得分越高意味着焦虑或抑郁的风险越高。之前伊朗研究者对HADS可靠性和有效性研究发现,每个HADS分量表最佳的分界点为6分(Kaviani et al., 2009)。
白氏抑郁量表Ⅱ(BDI-Ⅱ)是另外一项应用很广泛的自我评估打分量表,评估是否抑郁和抑郁程度,包含3个分量表:情感,身体和认知症状。这个量表包含21个抑郁症状,4个分值,从0(没有压力)到3(最大压力)。最高分为63分,得分越高意味着抑郁程度越高。之前伊朗研究者对BDI-Ⅱ可靠性和有效性研究发现,BDI-Ⅱ量表最佳的分界点为15分(Kaviani et al., 2009)。
●数据分析
利用SPSS软件11.5版本进行数据分析(美国伊利诺斯州芝加哥SPSS 公司)。数据以平均值±标准或者百分比表示。两组之间对比和组内对比分别用曼-惠特尼u检验和威尔克科森有符号秩检验。分类变量对比使用卡方检验。双侧检验p值<0.05则认为数据具有统计学意义。
结果
111名受试者完成实验,类姜黄素组61名,对照组50名。对照组有15名受试者因没有跟进而放弃,类姜黄素组有14名受试者放弃,其中9名因没有跟进放弃,3名因胃肠并发症放弃,2名因心跳加速、潮红和肠胃并发症放弃。2组的年龄,性别,体重,婚姻状态和已使用的抗抑郁药物基线数据均具有可比性(p>0.05),见表1。两组基线精神状态的BDI-Ⅱ得分或分量表得分均没有明显差异(p>0.05)。而类姜黄组HADS量表中焦虑基线得分高于对照组(p<0.001),抑郁基线得分没有明显差异(p>0.05)。

表1 受试者的人口统计学数据 | 制图:新营养
对比实验前和实验后数据发现,类姜黄素组和对照组HADS得分均有减少(p<0.001)。同样的,两组的焦虑分量表(p<0.001)和抑郁分量表(p<0.001)也均有减少(表2)。对比两组之间的数据发现,类姜黄素组HADS总得分和分量表得分减少更显著(p<0.001)(表3)。 两组BDI-Ⅱ得分均有减少(p<0.001),情绪(p<0.001)、身体(类姜黄素组p<0.001,对照组p=0.001)和认知(类姜黄素组p<0.001,对照组p<0.007)分量表得分也有相同趋势,见表2。对比两组数据发现,类姜黄素组BDI-Ⅱ总得分(p<0.001)和分量表身体(p<0.001)和认知(p<0.001)得分减少更显著。但情绪分量表得分,对照组减少更显著(p<0.001)(表3)。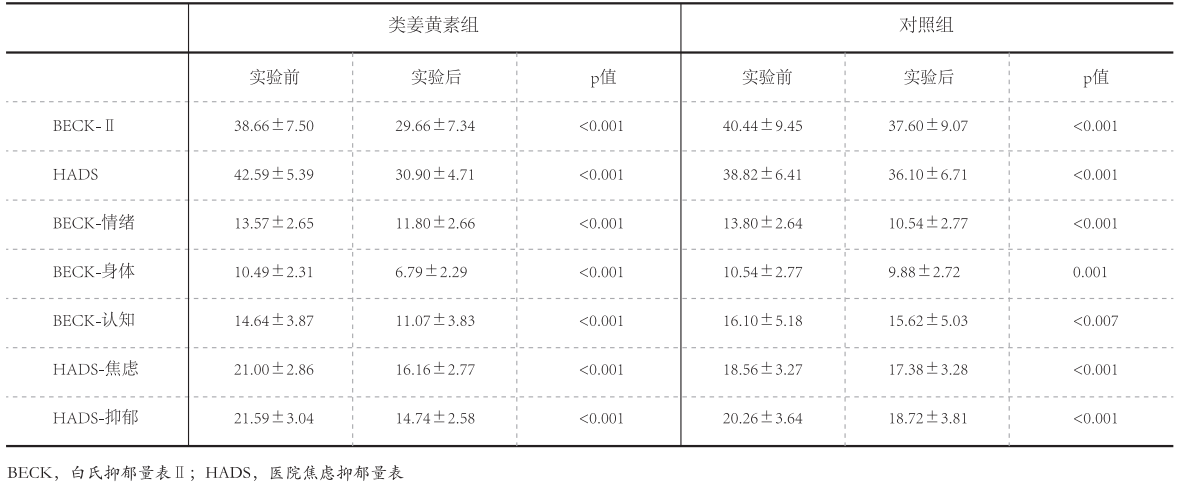 表2 实验前和试验后两组功效对比 | 制图:新营养
表2 实验前和试验后两组功效对比 | 制图:新营养
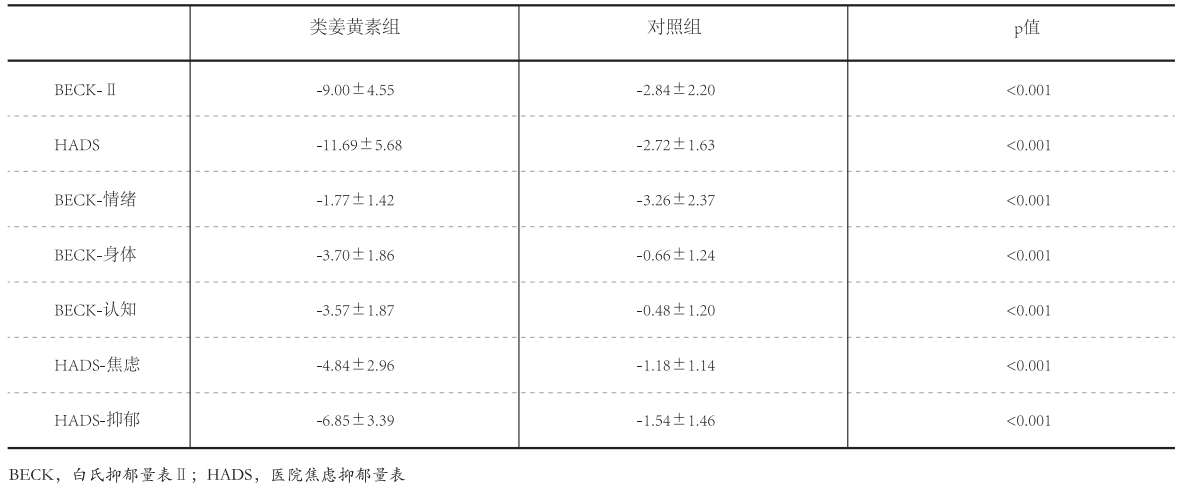 表3两组功效变化大小对比 | 制图:新营养
表3两组功效变化大小对比 | 制图:新营养
讨论
本文是类姜黄素食品补充剂对重度抑郁症功效的首批临床研究之一。结果证实类姜黄素可以减轻抑郁和焦虑症状,表现为白氏抑郁量表Ⅱ(BDI-Ⅱ)和医院焦虑抑郁量表(HADS)得分显著降低。就笔者所知,此前只有2篇类姜黄素对重度抑郁症患者的临床研究。一项是Sanmukhani等人进行的随机对照试验,重度抑郁症患者使用姜黄素(1000mg/天),氟西汀(20mg/天)或其组合,持续6周。利用汉密顿抑郁量表(HDRS)评估,结果表明单独使用姜黄素或单独使用氟西汀功效相当,但氟西汀/姜黄素组合并未显示出更强的功效(Sanmukhani et al., 2014)。另一项是Bergman等人进行的5周药物抗抑郁(西酞普兰或万拉法新)实验,姜黄素-胡椒碱(姜黄素500mg/天)作为外加一味结合药物治疗,利用临床抑郁程度量表(CGIS),汉密顿抑郁量表(HDRS)和蒙哥马利·阿斯伯格抑郁评定量表(MADRS)评估。结果发现,姜黄素与标准抗抑郁药物组合并未显示出对抑郁症更好的治疗效果。但与空白组相比,姜黄素具有更快缓解抑郁症状的趋势(Bergman et al., 2013)。值得考虑的是,上述两项实验与本文实验相比,测试样本数都更小。
之前不同的实验模型已经证实类姜黄素具有抗抑郁功效。在小鼠强迫游泳和尾悬挂实验中,类姜黄素能够减少固定时间,逆转利血平诱导的行为绝望,并且可以增强反苯环丙胺,司立吉林,万拉法新,氟西汀和安非他酮的抗固定作用(Kulkarni et al., 2008; Xu et al., 2005a)。在不同的抑郁实验模型中包括不可预测的轻微压力(Bhutani et al., 2009; Li et al., 2009),嗅球切除(Xu et al., 2005a),慢性疲劳(Gupta et al., 2009),类姜黄素还显示出纠正行为异常和生物化学异常的功效。
重度抑郁症是多种因子失调导致的疾病,其特点为一系列器官的失调,如下丘脑-脑垂体-肾上腺失调,神经递质释放失调,糖皮质激素抵抗,神经发生减少,炎症和氧化压力。有趣的是,因其多重功效和生物靶点作用,类姜黄素可以调节上述所有失调(Lopresti et al., 2012)。
类姜黄素抗抑郁功效最重要的机理是其强大的抗炎作用,(Sahebkar, 2014a; Shehzad et al., 2013b)。据文献报道,抑郁与炎症密切关联,主要反映在促炎因子水平升高,如IL- 1β、IL6、TNF-α,干扰素-γ和c-反应蛋白(Dowlati et al., 2010; Howren et al., 2009; Myint et al., 2005)。姜黄素通过抑制关键炎症因子抑制炎症反应,如NF-κb, COX-Ⅱ,丝裂原活化蛋白激酶和诱导型一氧化氮合酶(Strimpakos and Sharma, 2008; Zhou et al., 2011)。此外,在动物实验模型中,类姜黄素可以抑制脑组织中单胺氧化酶和提升血清素、多巴胺和去甲肾上腺素水平,同时减少谷氨酸--主要兴奋神经递质的含量(Kulkarni et al., 2008; Lin et al., 2011; Xia et al., 2007)。类姜黄素还能改善下丘脑-垂体-肾上腺失衡,减轻皮质酮引起的神经毒性(Xu et al., 2011)和提高海马神经因子水平、随后促进神经元生长和增殖(Xu et al., 2007 ),这些都是治疗抑郁症不可或缺的。类姜黄素通过抑制氧化应激反应保护神经,抑制活性氧簇产生和脂质过氧化(Wei et al., 2006)。这种抗氧化特性可以防止脑组织线粒体功能失调,从而减少因有氧代谢失衡和ATP产生减少而引起的相关神经精神并发症(Zhu et al., 2004)。
类姜黄素在临床应用中的主要问题是其生物利用度很低。在现有的各种解决低生物利用度问题的策略中,与胡椒碱联合使用已被证明是最有效的方法。胡椒碱是存在于黑胡椒(Piper nigrum L.)中主要的生物碱成分。它是一种著名的生物利用度增强剂,主要通过抑制小肠和肝脏内葡萄醛酸酶,来提高药物吸收并减少排泄来达到提升生物利用度作用(Atal et al., 1985; Shoba et al., 1998)。胡椒碱提高生物利用度的其他机理包括改变屏障细胞膜结构,增加肠组织灌注,抑制外排作用,如p -糖蛋白(Chearwae et al., 2004; Khajuria et al., 2002)。据文献报到,胡椒碱可显著提升姜黄素在人体(2000%)和大鼠(154%)中的生物利用度(Shoba et al., 1998)。此外,已有多项临床研究证实这种组合的其他相关功效(Mohammadi et al., 2013; Panahi et al., 2012a, 2012b; Sahebkar et al., 2013; Shoba et al., 1998)。
本文实验研究结果应考虑到一些局限性。首先,出于对照组的伦理考虑,姜黄素对抑郁症状的功效不受对照组药物影响。第二,本研究未评估单独使用类姜黄素的功效。但据本文和之前的研究(Sanmukhani et al., 2014),类姜黄素类有可能替代目前抗抑郁疗法。这对重度抑郁症患者非常有利,因为类姜黄素是非常安全的,即使在大剂量使用时(Cheng et al., 2001)。类姜黄素的安全性和良好的耐受性对需要长期治疗的重度抑郁症患者尤为重要。
结论
综上所述,本项临床实验结果证实,在标准抗抑郁疗法基础上复配使用姜黄素-胡椒碱是非常有效的,可显著缓解抑郁症状。今后需要进行更大样本量、盲标实验来证实目前的发现,并探索单独使用姜黄素-胡椒碱治疗重度抑郁症的功效性。最后,检测重度抑郁症患者在补充姜黄素-胡椒碱后血清中炎症因子水平的变化,将有助于证实类姜黄素的抗抑郁作用是否其抗炎特性有关。
参考文献
Ak T, Gulcin I. 2008. Antioxidant and radical scavenging propertiesof curcumin. Chem Biol Interact 174: 27–37.
Atal CK, Dubey RK, Singh J. 1985. Biochemical basis of enhanceddrug bioavailability by piperine: evidence that piperine is a potent inhibitor of drug metabolism. J Pharmacol Exp Ther232:258–262.
Bergman J, Miodownik C, Bersudsky Y et al. 2013. Curcumin as anadd-on to antidepressive treatment: a randomized, double-blind,placebo-controlled, pilot clinical study. Clin Neuropharmacol36:73–77.
Bhutani MK, Bishnoi M, Kulkarni SK. 2009. Anti-depressant likeeffect of curcumin and its combination with piperine in unpredictable chronic stress-induced behavioral, biochemical andneurochemical changes. PharmacolBiochemBehav92: 39–43.
Chearwae W, Anuchapreeda S, Nandigama K, Ambudkar SV,Limtrakul P. 2004. Biochemical mechanism of modulation ofhuman P-glycoprotein (ABCB1) by curcumin I, II, and III purifiedfrom turmeric powder. BiochemPharmacol68: 2043–2052.
Cheng AL, Hsu CH, Lin JK et al. 2001. Phase I clinical trial ofcurcumin, a chemopreventive agent, in patients with highrisk or pre-malignant lesions. Anticancer Res 21: 2895–2900.
Dowlati Y, Herrmann N, Swardfager W et al. 2010. A meta-analysisof cytokines in major depression. Biol Psychiatry 67: 446–457.
Ganjali S, Sahebkar A, Mahdipour E et al. 2014. Investigation ofthe effects of curcumin on serum cytokines in obese individuals: a randomized controlled trial. ScientificWorldJournal17: 898361. DOI: 10.1155/2014/898361. Gupta A, Vij G, Sharma S, Tirkey N, Rishi P, Chopra K. 2009.Curcumin, a polyphenolic antioxidant, attenuates chronic fatigue syndrome in murine water immersion stress model.Immunobiology214: 33–39.
Gupta SC, Kismali G, Aggarwal BB. 2013a. Curcumin, a component of turmeric: from farm to pharmacy. Biofactors39: 2–13.
Gupta SC, Patchva S, Aggarwal BB. 2013b. Therapeutic roles ofcurcumin: lessons learned from clinical trials. AAPS J 15: 195–218.
Howren MB, Lamkin DM, Suls J. 2009. Associations of depressionwith C-reactive protein, IL-1, and IL-6: a meta-analysis.Psychosom Med 71: 171–186.
Iranshahi M, Sahebkar A, Hosseini ST, Takasaki M, Konoshima T,
Tokuda H. 2010. Cancer chemopreventive activity of diversinfrom Feruladiversivittatain vitro and in vivo. Phytomedicine17: 269–273.
Kaviani H, Seyfourian H, Sharifi V, Ebrahimkhani N. 2009. Reliability and validity of Anxiety and Depression Hospital Scales(HADS): Iranian patients with anxiety and depression disorders. Tehran University Medical Journal 67: 379–385.
Khajuria A, Thusu N, Zutshi U. 2002. Piperine modulates permeability characteristics of intestine by inducing alterations in membrane dynamics: influence on brush border membrane fluidity,ultrastructure and enzyme kinetics. Phytomedicine 9: 224–231.
Kulkarni SK, Bhutani MK, Bishnoi M. 2008. Antidepressant activityof curcumin: involvement of serotonin and dopamine system.Psychopharmacology (Berl) 201: 435–442.
Li YC, Wang FM, Pan Y et al. 2009. Antidepressant-like effects ofcurcumin on serotonergic receptor-coupled AC-cAMP pathway in chronic unpredictable mild stress of rats. ProgNeuropsychopharmacol Biol Psychiatry 33: 435–449.
Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM. 2001.The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse. J Neurosci21: 8370–8377.
Lin TY, Lu CW, Wang CC, Wang YC, Wang SJ. 2011. Curcumin inhibits glutamate release in nerve terminals from rat prefrontalcortex: possible relevance to its antidepressant mechanism.Prog Neuropsychopharmacol Biol Psychiatry 35: 1785–1793.
Lopresti AL, Hood SD, Drummond PD. 2012. Multiple antidepressant potential modes of action of curcumin: a review of itsanti-inflammatory, monoaminergic, antioxidant, immunemodulating and neuroprotective effects. J Psychopharmacol26: 1512–1524.
Mohammadi A, Sahebkar A, Iranshahi M et al. 2013. Effects ofsupplementation with curcuminoids on dyslipidemia in obesepatients: a randomized crossover trial. Phytother Res 27:374–379.
Myint AM, Leonard BE, Steinbusch HW, Kim YK. 2005. Th1, Th2,and Th3 cytokine alterations in major depression. J AffectDisord88: 167–173.
Nemeroff CB. 2007. Prevalence and management of treatmentresistant depression. J Clin Psychiatry 68(Suppl 8): 17–25.Panahi Y, Sahebkar A, Amiri M et al. 2012a. Improvement of Sulphur mustard-induced chronic pruritus, quality of life and antioxidantstatus by curcumin: results of a randomised, double-blind,placebo-controlled trial. Br J Nutr108: 1272–1279.
Panahi Y, Sahebkar A, Parvin S, Saadat A. 2012b. A randomizedcontrolled trial on the anti-inflammatory effects of curcuminin patients with chronic sulphur mustard-induced cutaneouscomplications. Ann Clin Biochem49: 580–588.
Panahi Y, Rahimnia AR, Sharafi M, Alishiri G, Saburi A, SahebkarA. 2014a. Curcuminoid treatment for knee osteoarthritis: arandomized double-blind placebo-controlled trial. PhytotherRes. DOI: 10.1002/ptr.5174.
Panahi Y, Saadat A, Beiraghdar F, Sahebkar A. 2014b. Adjuvanttherapy with bioavailability-boosted curcuminoids suppressessystemic inflammation and improves quality of life in patientswith solid tumors: a randomized double-blind placebocontrolled trial. Phytother Res. DOI: 10.1002/ptr.5149.
Panahi Y, Saadat A, Beiraghdar F, Hosseini Nouzari SM, Jalalian HR,Sahebkar A. 2014c. Antioxidant effects of bioavailabilityenhanced curcuminoids in patients with solid tumors: A randomizeddouble-blind placebo-controlled trial. J Funct Foods 6: 615–622.
Rajasekar N, Dwivedi S, Tota SK et al. 2013. Neuroprotectiveeffect of curcumin on okadaic acid induced memory impairmentin mice. Eur J Pharmacol715: 381–394.
Sahebkar A. 2010. Molecular mechanisms for curcumin benefitsagainst ischemic injury. FertilSteril94: e75–e76; author replye77.
Sahebkar A. 2013. Why it is necessary to translate curcumin intoclinical practice for the prevention and treatment of metabolicsyndrome? Biofactors39: 197–208.
Sahebkar A. 2014a. Are curcuminoids effective C-reactive proteinlowering agents in clinical practice? Evidence from a metaanalysis. Phytother Res 28: 633–642.
Sahebkar A. 2014b. Curcuminoids for the management ofhypertriglyceridaemia. Nat Rev Cardiol11: 123.
Sahebkar A. 2014c. Low-density lipoprotein is a potential targetfor curcumin: novel mechanistic insights. Basic Clin PharmacolToxicol114: 437–438.
Sahebkar A, Mohammadi A, Atabati A et al. 2013. Curcuminoidsmodulate pro-oxidant-antioxidant balance but not the immuneresponse to heat shock protein 27 and oxidized LDL in obeseindividuals. Phytother Res 27: 1883–1888.
Samini F, Samarghandian S, Borji A, Mohammadi G, Bakaian M.2013. Curcumin pretreatment attenuates brain lesion sizeand improves neurological function following traumatic braininjury in the rat. PharmacolBiochemBehav110: 238–244.
Sanmukhani J, Satodia V, Trivedi J et al. 2014. Efficacy and safetyof curcumin in major depressive disorder: A randomized controlled trial. Phytother Res 28: 579–585.
Shehzad A, Lee J, Lee YS. 2013a. Curcumin in various cancers.Biofactors39: 56–68.
Shehzad A, Rehman G, Lee YS. 2013b. Curcumin in inflammatorydiseases. Biofactors39: 69–77.
Shoba G, Joy D, Joseph T, Majeed M, Rajendran R, Srinivas PS.1998. Influence of piperine on the pharmacokinetics ofcurcumin in animals and human volunteers. Planta Med 64:353–356.
Strimpakos AS, Sharma RA. 2008. Curcumin: preventive and therapeutic properties in laboratory studies and clinical trials.Antioxid Redox Signal 10: 511–545.
Wang R, Xu Y, Wu HL et al. 2008. The antidepressant effects ofcurcumin in the forced swimming test involve 5-HT1 and5-HT2 receptors. Eur J Pharmacol578: 43–50.
Wei QY, Chen WF, Zhou B, Yang L, Liu ZL. 2006. Inhibition of lipidperoxidation and protein oxidation in rat liver mitochondriaby curcumin and its analogues. BiochimBiophys Acta 1760:70–77.
World Health Organization. 2008. The global burden of disease:2004 update. Available at: http://www.who.int/healthinfo/global_burden_disease/2004_report_update/en/index.htm(accessed January 04 2014). Xia X, Cheng G, Pan Y, Xia ZH, Kong LD. 2007. Behavioral, neurochemical and neuroendocrine effects of the ethanolic extractfrom Curcuma longa L. in the mouse forced swimming test.J Ethnopharmacol110: 356–363.
Xu Y, Ku BS, Yao HY et al. 2005a. Antidepressant effects ofcurcumin in the forced swim test and olfactory bulbectomy models of depression in rats. PharmacolBiochemBehav82:200–206.
Xu Y, Ku BS, Yao HY et al. 2005b. The effects of curcumin ondepressive-like behaviors in mice. Eur J Pharmacol518: 40–46.
Xu Y, Ku B, Cui L et al. 2007. Curcumin reverses impaired hippocampal neurogenesis and increases serotonin receptor 1AmRNA and brain-derived neurotrophic factor expression inchronically stressed rats. Brain Res 1162: 9–18. Xu Y, Li S, Vernon MM et al. 2011. Curcumin prevents corticosteroneinduced neurotoxicity and abnormalities of neuroplasticity via5-HT receptor pathway. J Neurochem118: 784–795.
Yu ZF, Kong LD, Chen Y. 2002. Antidepressant activity of aqueous extracts of Curcuma longa in mice. J Ethnopharmacol83: 161–165.Zhou H, Beevers CS, Huang S. 2011. The targets of curcumin. CurrDrug Targets 12: 332–347.
Zhu YG, Chen XC, Chen ZZ et al. 2004. Curcumin protects mitochondria from oxidative damage and attenuates apoptosis incortical neurons. Acta Pharmacol Sin 25: 1606–1612.
Zigmond AS, Snaith RP. 1983. The Hospital Anxiety and Depression Scale. Acta PsychiatrScand67: 361–370.
新营养留言互动
您的电话不会被公开。 必填项已用 * 标注
相关热词搜索:
新营养峰会/活动
新营养热门资讯
共晶技术:让营养素步入埃米时代
XINGRAPHIC · 09-11
11月6-7日广州新营养趋势大会!30+演讲、2
风信社 · 09-08
当“造物”成为可能,人类营养健康产业将迎
XINGRAPHIC · 07-07
新营养周报 | 农夫山泉上新蓝靛果混合汁
数据 / 观察 · 01-06