肠道健康资讯
肠-肝轴再添新证!食源成分「萝卜硫素」或是调节肠道菌群改善“非酒精性脂肪肝”新希望
2023-02-28 10:02 来源:新营养
 图源:摄图网
图源:摄图网
世界上最常见的肝脏疾病是什么?
乙肝?丙肝?或者是酒精性肝病?都不是!答案是非酒精性脂肪性肝病(NAFLD)。目前,全球成年人中有25%患有NAFLD。据弗若斯特沙利文报告,中国非酒精性脂肪肝病患病人数呈上升趋势,2020年已接近2亿人,2016-2020年复合增长率为2.9%[1];在人口老龄化及肥胖、糖尿病等疾病因素的作用下,未来中国非酒精性脂肪肝病患病率会以更快的速度增长,将于2022年达到2.07亿人。
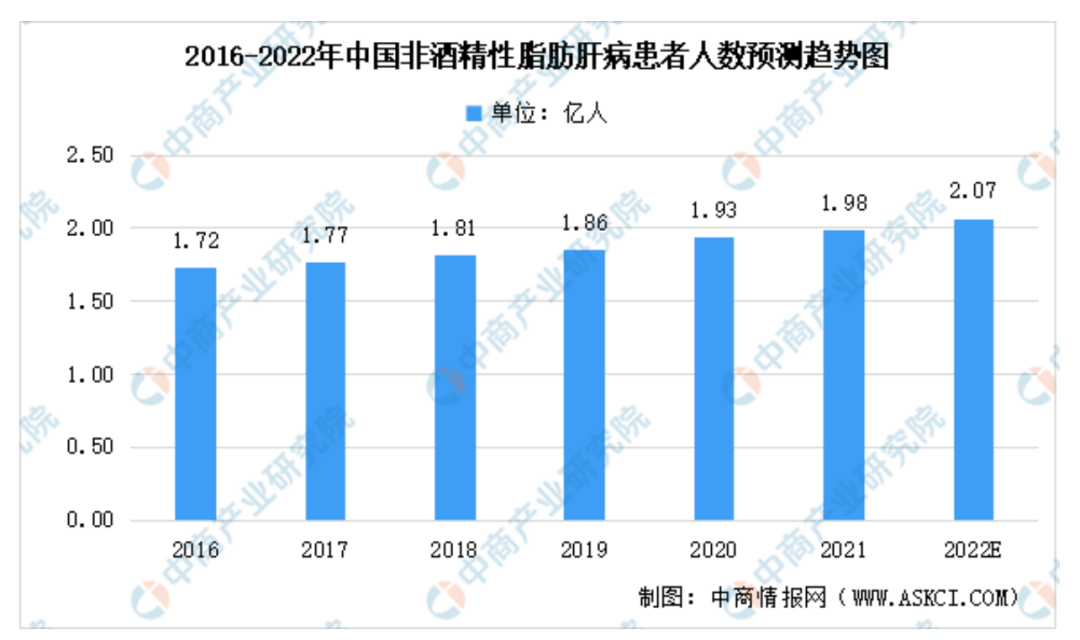
2016-2022年中国非酒精性脂肪肝病患者人数预测趋势图
图源:中商产业研究院
NAFLD正成为中国第一大慢性肝病和健康体检肝生物化学指标异常的首要原因,严重危害人民生命健康。NAFLD以过度肝脂肪变性、小叶炎症和肝细胞气球样改变为特征。此外,NAFLD可能发展为非酒精性脂肪性肝炎(NASH)和肝硬化,有可能导致肝癌[2]。根据现有的研究,NAFLD的发病机制可能与异常的葡萄糖和脂质代谢、炎症、内质网应激(ERS)、氧化应激和失衡的肠道微生物有关[3]。因此,其诊治越来越受临床医生的关注。目前陆续有报道认为肠道微生态的改变在NAFLD形成过程中起着关键作用。肝脏与肠道微生态不仅在解剖上,而且在功能上都有着密切的联系。
1. 肠道微生态和非酒精性脂肪性肝病的“爱恨情仇”
肝门系统在解剖学上连接肝脏和肠道,使肠道微生物群及其代谢产物参与NAFLD的发病机制。因此,肠-肝轴越来越被认为是NAFLD的一个关键因素[4]。
有研究在NAFLD动物模型和NAFLD患者中观察到肠道菌群失调和肠道通透性增加。肠道菌群失调可能会增加血清脂多糖(LPS),而LPS则可能损害肠道屏障功能,增加肠道通透性。紧密连接蛋白通过占据相邻肠细胞之间的细胞旁位置来调节肠道通透性,允许离子和小分子通过,并防止肠道微生物向肝脏转化。此外,肠道微生物群紊乱导致的肠道屏障完整性破坏被发现是NASH发展的先决条件[5]。同时,肠道炎症与ERS有关,ERS相关基因GPR78和CHOP蛋白的表达增加,伴随着IL-1β、TNF-α等肠道炎症基因的上调[6]。因此,肠道微生物紊乱和ERS可能破坏肠道完整性,并使肠道细菌产生的LPS能够通过血液循环进入门静脉,从而促进肝脏的炎症反应。
多项研究表明,LPS及其下游途径显著影响NAFLD诱导的肝脏炎症[7、8]。LPS可以被可被Toll样受体4(TLR4)识别以激活先天免疫系统,与此同时,基本衔接蛋白髓样分化初级反应88 (MyD88)被同步激活,导致NF-κB的活化和促炎性细胞因子的产生。因此,由肠源性LPS介导的TLR4/NF-κB炎症通路激活可能在NASH的发生和发展中起关键作用。
2. 食源成分萝卜硫素--改善“NAFLD”新希望
萝卜硫素(SFN)是一种天然异硫氰酸酯化合物,又称“莱菔硫烷”,具有强大的抗炎和抗癌特性[9]。在自然界中,SFN以其前体萝卜硫苷的形式存在于十字花科植物特别是西兰花种子中,进入体内后经过自身肠道菌群或外源黑芥子酶转化为SFN,激活细胞保护开关核因子红系2相关因子2(NrF2)发挥健康保护作用。
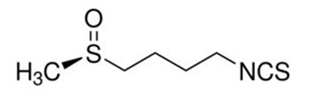
萝卜硫素结构式
研究表明,SFN被证实是Nrf2的天然诱导剂,保护线粒体功能,从而抑制NASH的发展。SFN还通过上调成纤维细胞生长因子(FGF)21/FGFR1途径改善NAFLD小鼠的脂质代谢紊乱。新的研究表明,SFN对肠道炎症表现出多重保护作用[10]。然而,关于SFN通过增强肠道屏障、调节肠道微生物群和脂多糖介导的肠-肝轴来改善NAFLD的假说仍有待阐明。发表在Nutrients的一项研究发现,食源成分萝卜硫素或可通过肠-肝轴的LPS/TLR4改善高脂高果糖饮食诱导的非酒精性脂肪性肝病[11]。
给C57BL/6小鼠喂食高脂肪和高果糖(HFHFr)饮食,以15和30mg·kg−1体重的剂量灌胃或不灌胃SFN,持续12周。结果表明,SFN降低了HFHFr小鼠的体重增加、肝脏炎症和脂肪变性。SFN改变了肠道微生物的组成。此外,SFN增强了肠道紧密连接蛋白ZO-1,降低了血清LPS,并抑制了LPS/TLR4和ERS通路,以减少肠道炎症。因此,SFN保护了HFHFr饮食诱导小鼠的肠道完整性,并减少了肠源性LPS向肝脏的转移;SFN降低肝脏LPS水平,抑制LPS/TLR4通路激活,从而抑制促炎细胞因子;值得注意的是,Spearman相关分析表明,SFN对肠屏障完整性的保护作用及其对肝脏的抗炎作用与改善肠道失调有关。最重要的是,SFN的饮食干预通过肠-肝轴减少NAFLD。
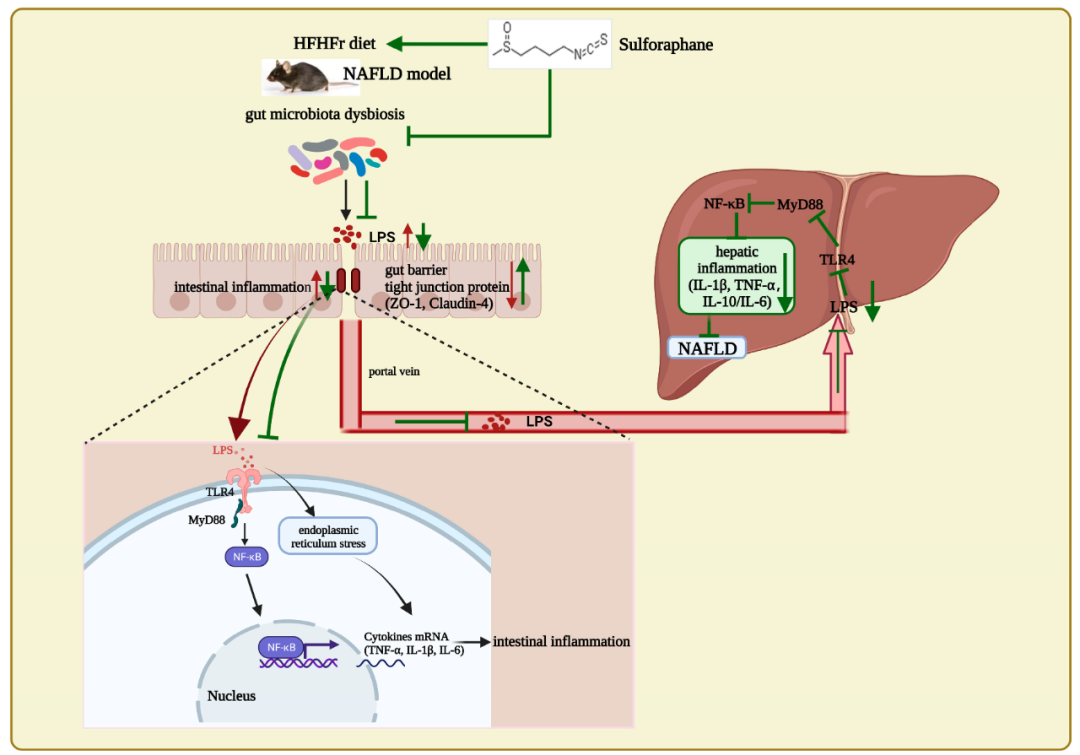
萝卜硫素通过肠-肝轴的LPS/TLR4改善高脂高果糖饮食诱导的非酒精性脂肪性肝病
总之,研究强调了SFN通过调节小鼠肠道微生物群和抑制LPS-TLR4-NF-κB炎症通路来预防NAFLD的发生,这意味着SFN是预防和改善NAFLD的潜在天然产物。
3. 重视非酒精性脂肪肝,保护好你的“小心肝”
当下,非酒精性脂肪肝越来越“青睐”年轻人,此类人群处于事业打拼期,常忙于工作和应酬,缺乏体育锻炼,最终导致体重超标甚至成为肥胖症。这些都是导致非酒精性脂肪肝出现的因素。
面对非酒精性脂肪肝,目前还没有药物干预的手段,只能在生活中积极主动的预防,通过控制饮食、合理锻炼等习惯进行调理。上文研究证明,SFN或可通过肠-肝轴的LPS/TLR4改善高脂高果糖饮食诱导的非酒精性脂肪性肝病,该研究结果揭示了SFN作为一种有发展前景、能预防非酒精性脂肪肝的天然产物的潜在作用。
参考文献:
[1]《2022年中国非酒精性脂肪肝市场数据及其药物研发趋势预测分析》中商产业研究院
[2]Corey, K.E.; Pitts, R.; et al. ADAMTSL2 protein and a soluble biomarker signature identify at-risk non-alcoholic steatohepatitis and fibrosis in adults with NAFLD. J. Hepatol. 2022, 76, 25–33.
[3]Porras, D.; Nistal, E.; et al. Sánchez-Campos, S. Protective effect of quercetin on high-fat diet-induced non-alcoholic fatty liver disease in mice is mediated by modulating intestinal microbiota imbalance and related gut-liver axis activation. Free. Radic. Biol. Med. 2017, 102, 188–202.
[4]Albillos, A.; de Gottardi, A.; Rescigno, M. The gut-liver axis in liver disease: Pathophysiological basis for therapy. J. Hepatol. 2020, 72, 558–577.
[5]Mouries, J.; Brescia, P.; et al. Microbiota-driven gut vascular barrier disruption is a prerequisite for non-alcoholic steatohepatitis development. J. Hepatol. 2019, 71, 1216–1228.
[6]Zhao, L.; Liang, J.; Chen, F.; et al. High carbohydrate diet induced endoplasmic reticulum stress and oxidative stress, promoted inflammation and apoptosis, impaired intestinal barrier of juvenile largemouth bass (Micropterus salmoides). Fish Shellfish Immunol. 2021, 119, 308–317.
[7]Wang, Q.; et al. Naringenin attenuates non-alcoholic fatty liver disease by down-regulating the NLRP3/NF-κB pathway in mice. Br. J. Pharmacol. 2020, 177, 1806–1821.
[8]Zhang, H.; Gao, X.; Chen, P.; Wang, H. Protective Effects of Tiaoganquzhi Decoction in Treating inflammatory Injury of Nonalcoholic Fatty liver Disease by Promoting CGI-58 and Inhibiting Expression of NLRP3 Inflammasome. Front. Pharmacol. 2022, 13, 851267.
[9]Youn, H.S.; Kim, Y.S.; et al. Sulforaphane suppresses oligomerization of TLR4 in a thiol-dependent manner. J. Immunol. 2010, 184, 411–419.
[10]Wei, L.Y.; Zhang, J.K.; Zheng, L.; Chen, Y. The functional role of sulforaphane in intestinal inflammation: A review. Food Funct. 2022, 13, 514–529.
[11]Ye Xu,Xianghui Huang,Bingxin Huangfu,et al.Sulforaphane Ameliorates Nonalcoholic Fatty Liver Disease Induced by High-Fat and High-Fructose Diet via LPS/TLR4 in the Gut–Liver Axis.Nutrients 2023, 15(3), 743; https://doi.org/10.3390/nu15030743
新营养留言互动
您的电话不会被公开。 必填项已用 * 标注
相关热词搜索:
新营养峰会/活动
新营养热门资讯
共晶技术:让营养素步入埃米时代
XINGRAPHIC · 09-11
11月6-7日广州新营养趋势大会!30+演讲、2
风信社 · 09-08
当“造物”成为可能,人类营养健康产业将迎
XINGRAPHIC · 07-07
新营养周报 | 农夫山泉上新蓝靛果混合汁
数据 / 观察 · 01-06