数据 / 观察资讯
碎片化睡眠的新希望——尿石素A最新人体临床实验
2025-06-10 13:20 来源:新营养
 作为抗衰领域的前沿成分,尿石素 A(Urolithin A)这一天然多酚代谢产物,凭借其独特的细胞代谢调控机制,近年成为科学界与产业界的关注焦点。
作为抗衰领域的前沿成分,尿石素 A(Urolithin A)这一天然多酚代谢产物,凭借其独特的细胞代谢调控机制,近年成为科学界与产业界的关注焦点。
邦尚健康作为尿石素 A 原料生产商,始终以医药级标准生产高纯度原料,并秉持 “科学先行” 的研发理念持续投入临床探索与验证。继 2025 年上半年完成首项口服美容临床实验后,第二项关于尿石素 A 改善睡眠质量的临床研究也已通过伦理审查并进入实施阶段。这项针对中老年人睡眠健康的随机平行四盲对照实验,不仅聚焦碎片化睡眠、昼夜节律失调等现代健康问题,更旨在通过多维度生物标志物监测,系统性验证尿石素A在睡眠和抗衰领域的全谱价值。
一、睡眠危机:现代生活方式下的“衰老加速器”
数据显示,全球 30%~35% 的成年人受困于睡眠障碍1。在数字化浪潮中,熬夜工作、碎片化娱乐、昼夜颠倒等生活方式已成为常态,由此引发的睡眠不足问题正成为从细胞、器官到系统层面加速人体衰老进程的“隐形杀手”。
01 碎片化睡眠:
从“睡眠剥夺”到“细胞损伤”的级联反应
碎片化睡眠是一种常见的睡眠障碍,指在睡眠过程中由于外源和内源性因素导致的睡眠中断和觉醒,睡眠不深且不连贯2。研究显示,约65.91%的被调查者有此类睡眠困扰,其中,35~44岁年龄段的睡眠困扰率最高,达71.95%3,其危害远超单纯的疲劳感:
▌细胞代谢紊乱:睡眠中断会破坏肌细胞蛋白合成,增加心肌中的脂肪酸氧化和自由基ROS,同时在肝细胞中引发氧化应激,导致肝脏损伤4;
▌衰老细胞蓄积:慢性睡眠不足使细胞衰老标志物p16INK4a的表达在小鼠主动脉壁中显著增加,且细胞促炎因子IL-6增加约1倍,加速炎症和组织退化5;
▌代谢综合征风险:碎片化睡眠会增加机体胰岛素抵抗的发生率和血糖水平,与内脏脂肪堆积形成恶性循环4。
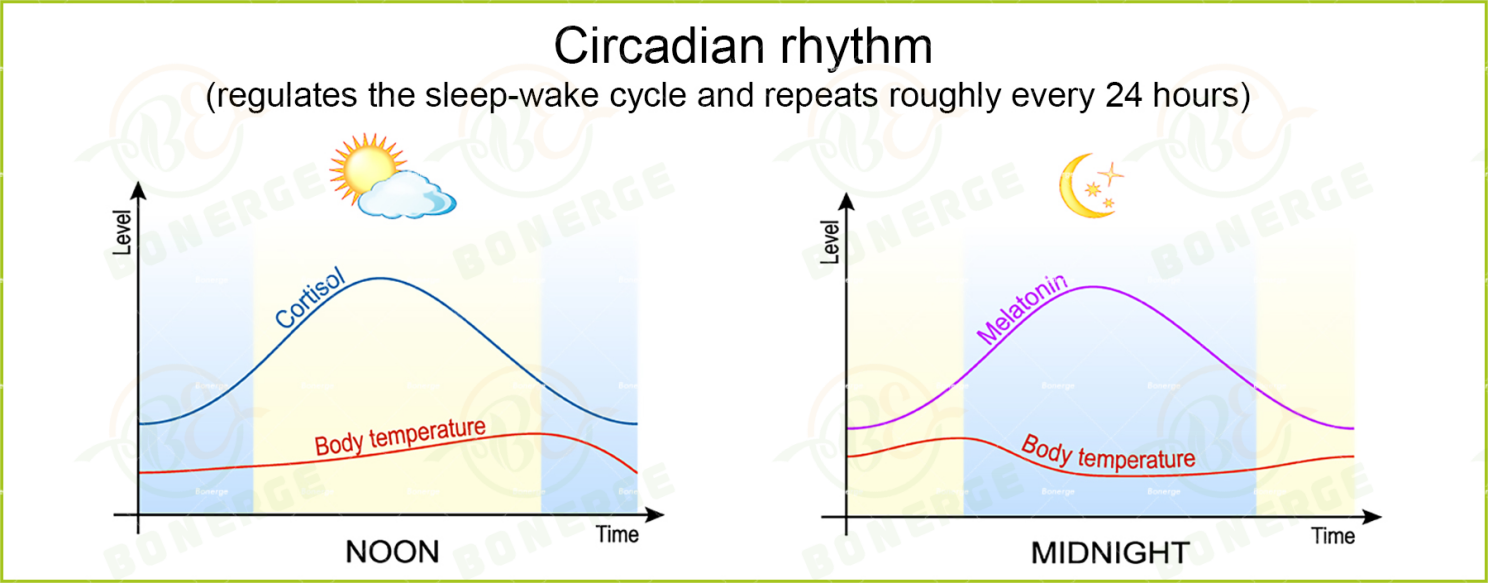
02 昼夜节律失调:当“生物钟”遭遇“光污染”
现代社会的光照环境(如蓝光暴露)与不规律作息,正系统性破坏人体昼夜节律。作为调控睡眠-觉醒周期的核心机制,昼夜节律通过视交叉上核(SCN)协调全身基因表达的24小时振荡6。研究表明,昼夜节律失调对健康的影响深刻而广泛:
▌时钟基因异常:夜班工作者的时钟基因PER1和BMAL1节律普遍延迟~2.5至3小时,进一步影响褪黑素分泌节律7;
▌炎症失控:节律紊乱使Th17细胞活化增强,IL-17A水平升高,与银屑病、类风湿关节炎等炎症性问题密切相关8(Th17 细胞是一类促炎型 T 细胞亚群,IL-17A 是其分泌的核心细胞因子,两者是机体炎症反应和自身免疫性疾病的关键驱动因素)。
▌NAD+代谢失衡:NAD+(烟酰胺腺嘌呤二核苷酸) 是维持细胞代谢和能量稳态的重要辅酶,而SIRT1 蛋白是NAD⁺代谢的重要调控因子,其昼夜节律性波动受时钟基因调控。当生物节律紊乱时,NAD⁺峰值浓度会显著下降,大大削弱细胞能量稳态的维持能力9。
03 更年期睡眠障碍:
雌激素撤退引发的“多重打击”
女性睡眠困难通常始于绝经过渡期,绝经后患病率增加,自我报告的睡眠问题发生率为40%-56%10,其主要病理机制涉及:
▌雌激素受体重塑:雌激素撤退导致大脑视前区GAT-1GABA转运蛋白基因转录降低,从而减少细胞外GABA浓度,增加夜间觉醒风险11。
▌血管舒缩症状:约85%的更年期女性有潮热症状,潮热发作时,核心体温会发生急速小范围波动,从而影响睡眠周期12。
04 情绪-睡眠负反馈循环:
焦虑抑郁与睡眠障碍“如影随形”
现焦虑和抑郁患者常面临严重的睡眠问题,而长期睡眠障碍也会进一步增加焦虑和抑郁风险,与白班工人相比,夜班工人患抑郁症的可能性要高40%13,二者相互影响的核心机制包括:
▌皮质醇节律异常:抑郁会导致激素节律,如褪黑素和皮质醇节律的振幅降低,影响大脑中基因表达的昼夜节律模式,从而导致睡眠障碍13。
▌血清素功能失调:血清素分泌也受昼夜节律控制,长期睡眠障碍易使血清素(5-HT)神经递质功能失调,导致抑郁焦虑等不良情绪发生或加剧14。
 二、尿石素A的“睡眠-抗衰-美肤”三重调控:
二、尿石素A的“睡眠-抗衰-美肤”三重调控:
白天有精力,夜晚睡得香,肌肤焕活力睡
01 双轴调节昼夜节律,从肠道到全身的时钟同步
尿石素 A 的独特优势在于其对肠道 - 全身节律轴的双向调控:
▌肠道屏障节律修复:昼夜节律对维持肠道稳态及免疫功能起决定性作用。尿石素 A 可通过调控肠道上皮细胞中核心时钟基因的表达节律,逆转炎症诱导的时钟基因与紧密连接蛋白节律紊乱。在动物模型中,尿石素 A 不仅恢复了小鼠结肠组织中紧密连接蛋白(Clnd1、Clnd4)和时钟基因(BMAL1、PER2)的正常表达节律,还有效调节下丘脑视交叉上核(SCN)的中枢时钟系统15。
▌衰老细胞节律重编程:昼夜节律时钟精准调控生物体的多项生理活动,而衰老进程会削弱其时间精度与稳健性,表现为基因振荡的节律延长、振幅衰减。在衰老及增殖状态的 TIG-3细胞模型中,尿石素 A 可显著增强BMAL1 启动子驱动的荧光素酶振荡振幅,衰老细胞的振幅提升达约 4 倍,且呈剂量依赖性16, 提示其对衰老细胞的节律功能具有深度修复作用。
 02 增强NAD内源合成能力,促进细胞能量代谢
02 增强NAD内源合成能力,促进细胞能量代谢
▌研究表明,尿石素A可以显著提升细胞NAD+水平,促进细胞能量代谢,帮助提升日间精力。动物实验中,补充尿石素 A后,小鼠体内的NAD+水平显著提升50%,且其提升效能相当于5倍剂量的NR17。
▌值得关注的是,尿石素A对NAD+的提升不同于外源性前体补充,而是通过激活 SIRT1-NAMPT 通路,从源头增强NAD+的内源性合成能力17。这种增强自然代谢的机制,为长期服用的安全性提供了理论支撑。
03 改善睡眠剥夺性疲劳,提升日间生理机能
▌在睡眠剥夺小鼠模型中,尿石素 A 展现出优于咖啡因的抗疲劳特性。补充尿石素 A 后,睡眠剥夺小鼠的握力相较于未补充组提升了 35%(咖啡因组仅 12%)。在评估小鼠的平衡能力和运动耐力的转棒实验(ROTA-ROD)中,补充尿石素A 的小鼠感受到疲劳的时间大幅延长,改善幅度约为 100%,同时还改善了睡眠剥夺小鼠的肠道菌群失调18。
04 睡出好皮肤,昼夜节律驱动的皮肤年轻通路
▌睡眠是皮肤的“天然美容剂”,其对皮肤的影响本质上是昼夜节律、激素平衡、屏障功能共同作用的结果。长期睡眠不足会从基因表达、细胞代谢到宏观结构层面加速皮肤衰老。对于现代人而言,将“睡出好皮肤”纳入健康管理,或许比任何昂贵护肤品都更具性价比。
▌夜间是皮肤自我修复的黄金时段,从机制上看,尿石素A可增强皮肤成纤维细胞BMAL1节律振幅,提升胶原蛋白合成相关基因(如COL1A1)的表达,从而促进受损屏障修复与弹性纤维再生。
 三、尿石素A开启睡眠与抗衰实证临床研究
三、尿石素A开启睡眠与抗衰实证临床研究
01 睡眠质量临床:解码衰老与睡眠的交互机制
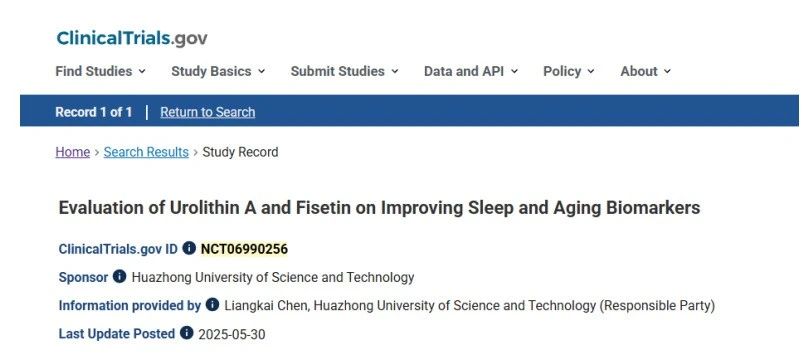
邦尚健康于 2025 年初启动的尿石素 A 睡眠质量干预临床研究(美国临床注册号 #NCT06990256),旨在从衰老生物学视角探索睡眠障碍的解决路径。
该项随机对照研究预计纳入 80 名 45-70 岁受试者,采用四盲设计(受试者、医护人员、研究者、评估者均设盲),设置尿石素 A 组、非瑟酮组、联合组及淀粉安慰剂组,进行 12 周干预。首次系统性评估尿石素 A 对昼夜节律重整及衰老相关睡眠障碍的干预潜力。
02 临床核心研究设计:
▌入组标准:睡眠质量受损但未达病理诊断的亚临床人群(PSQI 评分 > 5 分),排除咖啡因 / 酒精依赖者,确保干预效果的纯粹性。
▌多维度评估:
■主观指标:睡眠质量评分、昼夜类型问卷(晨型 / 夜型倾向)、日间功能障碍量表;
■客观指标:体动记录仪连续监测、多导睡眠图分析;
■生物标志物:NAD+ 水平、DNA 甲基化年龄、炎症因子(血浆白细胞介素)、皮质醇水平、节律蛋白、胰岛素抵抗指数、免疫球蛋白水平等。
“我们不仅关注睡眠时长与碎片化程度,更希望通过表观遗传时钟、代谢稳态等指标,揭示睡眠障碍与衰老进程的因果关系。” 项目负责人表示,“尿石素 A 与非瑟酮的联合用药设计,旨在探索 “昼夜节律调节 + 衰老细胞清除” 的协同效应,这或将为更年期睡眠障碍等复杂场景提供新方案
 四、邦尚健康的科学承诺:从“原料创新” 到 “健康生态”
四、邦尚健康的科学承诺:从“原料创新” 到 “健康生态”
作为高纯度尿石素 A 生产企业,邦尚健康的研发路径始终遵循 “原料科学 - 机制研究 - 临床转化” 的全链条布局。邦尚健康正面向全球招募临床合作伙伴,欢迎学术界、产业界共同探索尿石素 A 在睡眠健康,细胞抗衰等更多领域的应用潜力。
当 “抗衰老” 从消费主义叙事转向科学理性,邦尚健康以尿石素 A 为支点,撬动的不仅是单一成分的市场价值,更是整个行业对 “证据为本” 的回归。从皮肤到睡眠,从分子机制到临床终点,未来的抗衰解决方案,必须是机制清晰、数据明确、场景精准的系统性方案。
 参考文献:
参考文献:
[1] Luis San, Belén Arranz, The Night and Day Challenge of Sleep Disorders and Insomnia: A Narrative Review. Actas Esp Psiquiatr, 2024 Feb 5;52(1):45-56.
[2] Bhagavan, S. M., & Sahota, P. K. (2021). Sleep Fragmentation and Atherosclerosis: is There a Relationship?. Missouri medicine, 118(3), 272–276.
[3] Wang Junxiu, Zhang Yan, Li Yanze. China Sleep Research Report[M]. Social Sciences Academic Press, 2025.
[4] Feeney, S. P., McCarthy, J. M., Petruconis, C. R., & Tudor, J. C. (2025). Sleep loss is a metabolic disorder. Science signaling, 18(881), eadp9358.
[5] Carreras, A., Zhang, S. X., Peris, E., Qiao, Z., Gileles-Hillel, A., Li, R. C., Wang, Y., & Gozal, D. (2014). Chronic sleep fragmentation induces endothelial dysfunction and structural vascular changes in mice. Sleep, 37(11), 1817–1824.
[6] Bonmati-Carrion, M. A., Arguelles-Prieto, R., Martinez-Madrid, M. J., Reiter, R., Hardeland, R., Rol, M. A., & Madrid, J. A. (2014). Protecting the melatonin rhythm through circadian healthy light exposure. International journal of molecular sciences, 15(12), 23448–23500.
[7] Boivin, D. B., Boudreau, P., & Kosmadopoulos, A. (2022). Disturbance of the Circadian System in Shift Work and Its Health Impact. Journal of biological rhythms, 37(1), 3–28.
[8] Mosure, S. A., Wilson, A. N., & Solt, L. A. (2022). Targeting Nuclear Receptors for TH17-Mediated Inflammation: REV-ERBerations of Circadian Rhythm and Metabolism. Immunometabolism, 4(2), e220006.
[9] Yang, Z., Zarbl, H., Kong, B., Taylor, R., Black, K., Kipen, H., Basaly, V., Fang, M., & Guo, G. L. (2024). Liver-gut axis signaling regulates circadian energy metabolism in shift workers. FASEB journal : official publication of the Federation of American Societies for Experimental Biology, 38(22), e70203.
[10] Kravitz, H. M., Ganz, P. A., Bromberger, J., Powell, L. H., Sutton-Tyrrell, K., & Meyer, P. M. (2003). Sleep difficulty in women at midlife: a community survey of sleep and the menopausal transition. Menopause (New York, N.Y.), 10(1), 19–28.
[11] Herbison A. E. (1997). Estrogen regulation of GABA transmission in rat preoptic area. Brain research bulletin, 44(4), 321–326.
[12] Santoro, N., Epperson, C. N., & Mathews, S. B. (2015). Menopausal Symptoms and Their Management. Endocrinology and metabolism clinics of North America, 44(3), 497–515.
[13] Walker, W. H., 2nd, Walton, J. C., DeVries, A. C., & Nelson, R. J. (2020). Circadian rhythm disruption and mental health. Translational psychiatry, 10(1), 28.
[14] Pourhamzeh, M., Moravej, F. G., Arabi, M., Shahriari, E., Mehrabi, S., Ward, R., Ahadi, R., & Joghataei, M. T. (2022). The Roles of Serotonin in Neuropsychiatric Disorders. Cellular and molecular neurobiology, 42(6), 1671–1692.
[15] Yao Du, Xinyue Chen et al. Effect of Urolithin A on the Improvement of Circadian Rhythm Dysregulation in Intestinal Barrier Induced by Inflammation. Nutrients 2024, 16, 2263.
[16] Rassul Kuatov, Jiro Takano et al. Urolithin A Modulates PER2 Degradation via SIRT1 andEnhances the Amplitude of Circadian Clocks in HumanSenescent Cells. Nutrients 2025, 17, 20.】
[17] Ghosh Nandini, et al. Urolithin A augments angiogenic pathways in skeletal muscle by bolstering NAD+ and SIRT1. Sci Rep. 2020 Nov 19;10(1):20184.
[18] Hongkang Zhu, Haotian Zhao et al. Urolithin A Ameliorates Athletic Ability and Intestinal Microbiota in Sleep Deprivation from the Perspective of the Gut-Muscle Axi. Mol Nutr Food Res. 2024 Apr;68(7):e2300599.
END
>>>声明
*新营养(xinyingyang.com)致力于秉承循征营养学的理念,重度垂直人类营养,为广大健康原辅料供应商和消费者之间架起沟通的桥梁,标明原创的文章权限为本网所有,如需转载请得到书面申请并在文章开头注明出处。
*文章中会充列示参考文献,但因商业利益相关造成的不客观可能依然存在,欢迎读者多提出批评意见和建议。
*文章中涉及功效相关描述均有对应的数据支持,囿于篇幅限制无法全部刊登,如需数据来源,可向新营养(xinyingyang.com)或文章中涉及到的企业索取。文章图片部分来源于网络,如有侵权请告知删除。
*此公众号中全部内容仅为一般性参考。读者不应在缺乏具体的专业建议的情况下,擅自根据文章内容中的任何信息采取行动。此公众号运营方将不对任何因采用文章内容而导致的损失负责。
*文章中涉及的产品、成分、功效仅代表相关企业的观点,新营养仅基于信息传递目的进行转述,并不代表我们绝对认同相关宣称,也不支持任何产品的营销和销售。
*文章中插入的图片不涉及到商业行为,仅限交流,并标明了来源出处,尊重原创图片设计。
新营养留言互动
您的电话不会被公开。 必填项已用 * 标注
相关热词搜索:
上一篇:茶饮新潮流掀起狂澜!瑞幸、果子熟了、可可满分力推“流量新霸主”
下一篇:新营养周报 | 蒙牛上新奶特抹茶牛乳、霸王茶姬北京校园首店入驻清华大学、大脑调控进食的关键机制为肥胖打开新大门
新营养峰会/活动
新营养热门资讯
共晶技术:让营养素步入埃米时代
XINGRAPHIC · 09-11
11月6-7日广州新营养趋势大会!30+演讲、2
风信社 · 09-08
当“造物”成为可能,人类营养健康产业将迎
XINGRAPHIC · 07-07
新营养周报 | 农夫山泉上新蓝靛果混合汁
数据 / 观察 · 01-06